Гидроксиды являются одним из классов неорганических соединений, которые образуются при реакции щелочей и кислот с образованием солей и воды. Они представляют собой соединения, в которых анион ОН- связан с катионом. Гидроксиды обладают определенным характером, который определяет их свойства и значение в различных сферах жизни.
Характер гидроксида определяется его способностью образования гидроксильного ион и обратную его реакцию воды на водород и кислород. В зависимости от величины константы обратной реакции различают разные типы гидроксидов: сильные (очень и сильные) и слабые (слабые и очень слабые).
Сильные гидроксиды, такие как NaOH (гидроксид натрия), Ca(OH)2 (гидроксид кальция) и KOH (гидроксид калия), образуются в результате реакции щелочей с кислотами. Они полностью диссоциируют в воде и обладают сильным щелочным свойством. Благодаря этому они находят широкое применение в промышленности, в том числе в процессе производства мыла и стекла.
Слабые гидроксиды, такие как Mg(OH)2 (гидроксид магния) и Fe(OH)3 (гидроксид железа), обладают низкой растворимостью в воде. Они образуются в результате реакции некоторых кислот с основаниями. Слабые гидроксиды имеют слабое щелочное свойство и находят применение в производстве лекарственных препаратов и косметических средств.
Таким образом, характер гидроксида определяет его активность и свойства. Он имеет важное значение в различных областях, включая химическую промышленность, медицину и косметологию.
Характер гидроксида: понятие и значения

Основная характеристика гидроксидов – щелочность. Из-за наличия ионов гидроксильного радикала в составе, гидроксиды образуют щелочные растворы. Они могут реагировать с кислотами, образуя соль и воду. Благодаря этому свойству гидроксиды находят широкое применение в различных отраслях, включая производство химических веществ, фармацевтику, пищевую промышленность и многое другое.
Также гидроксиды обладают амфотерными свойствами, то есть могут проявлять и щелочные, и кислотные свойства в зависимости от реагента, с которым они контактируют. Например, гидроксиды алюминия и железа проявляют кислотные свойства при контакте с щелочами, а с кислотами – щелочные свойства.
С точки зрения растворимости, гидроксиды делятся на растворимые и нерастворимые. Растворимые гидроксиды хорошо растворяются в воде и дают щелочные растворы. Нерастворимые гидроксиды, напротив, плохо растворяются в воде и имеют меньшую растворимость.
Изучение характера гидроксидов играет важную роль в химии, так как позволяет понять их реакционные свойства и потенциальные применения. С учетом характера гидроксидов можно выбирать оптимальные условия и реагенты для проведения химических реакций.
Гидроксид: определение и свойства
Основные свойства гидроксидов:
- Основность: гидроксиды обладают выраженными основными свойствами, так как они способны принимать протоны от кислот и образовывать соли. В растворе они образуют щелочную среду.
- Растворимость: некоторые гидроксиды растворяются в воде с образованием гидроксокомплексов, а некоторые практически не растворяются.
- Автодиссоциация: гидроксиды образуют равновесные растворы, которые способны автодиссоциироваться на ионы гидроксила и ионы катиона. Концентрация ионов гидроксила определяет щелочность раствора.
- Амфотерность: некоторые гидроксиды проявляют амфотерные свойства, то есть они могут действовать как основания и как кислоты.
- Реакция с кислотами: гидроксиды реагируют с кислотами, образуя соли и воду.
- Реакция с кислородокислотами: гидроксиды могут реагировать с соответствующими кислородокислотами, образуя соли и воду.
- Получение: гидроксиды могут быть получены путем реакции оксида металла с водой или раствором щелочи.
Гидроксиды находят широкое применение в различных областях, включая промышленность, медицину, а также в бытовых условиях. Они широко используются в качестве основных или адсорбционных компонентов в процессах очистки воды и сточных вод, а также в производстве различных продуктов.
Гидроксиды: классификация и типы
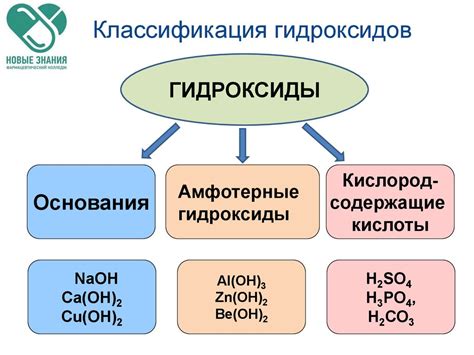
Вот некоторые из них:
| Тип гидроксида | Описание | Примеры |
|---|---|---|
| Литиевые гидроксиды | Гидроксиды, содержащие ион Li+ | LiOH |
| Натриевые гидроксиды | Гидроксиды, содержащие ион Na+ | NaOH |
| Калиевые гидроксиды | Гидроксиды, содержащие ион K+ | KOH |
| Магниевые гидроксиды | Гидроксиды, содержащие ион Mg2+ | Mg(OH)2 |
| Железные гидроксиды | Гидроксиды, содержащие ион Fe3+ | Fe(OH)3 |
Классификация гидроксидов основывается на типе металла и его окислительном состоянии в соединении. Их свойства и применения могут различаться в зависимости от их состава и структуры.
Гидроксиды широко используются в различных областях, включая промышленность, медицину и бытовые нужды. Они могут быть использованы в качестве щелочей, оксидантов, стабилизаторов pH, а также в процессах обезжелезивания и очистки воды.