Водород – самый простой и распространенный элемент во Вселенной. Он есть во всех живых организмах и играет важную роль в химических процессах. Но стоящие до водорода элементы также имеют значительное влияние на химические соединения, в которых они участвуют.
Первым элементом, который находится перед водородом в периодической системе элементов, является гелий. Гелий является инертным газом, что означает, что он не реагирует с другими веществами без искусственного вмешательства. Однако гелий часто используется в научных и технических целях, например, в заполнении аэростатов или в качестве среды для охлаждения некоторых приборов.
Вторым элементом перед водородом является гелий. Литий – легкий металл, который обладает высокой реактивностью. Он активно реагирует с водой и кислородом, что делает его непригодным для хранения воздуха. Литий имеет широкое применение в батареях и препаратах для лечения некоторых психических расстройств.
Таким образом, стоящие до водорода элементы – гелий и литий – играют важную роль в химических соединениях. Гелий – инертный газ, который часто используется в научных и технических целях, а литий – реактивный металл, который активно реагирует с другими веществами. Понимание и использование свойств этих элементов существенно в различных областях науки и технологий.
Первое важное соединение до водорода
Роль в химических реакциях
Водород играет важную роль в химических реакциях и образовании соединений. Благодаря своей высокой реакционной активности и универсальности, он может вступать во множество химических реакций и образовывать различные соединения.
Одним из наиболее известных примеров реакции с участием водорода является водородное горение. При сжигании водорода в присутствии кислорода образуется вода:
- 2H2 + O2 → 2H2O
Водород также может вступать в химические реакции с несколькими другими элементами и образовывать различные соединения. Например, реакция водорода с хлором приводит к образованию хлороводорода:
- H2 + Cl2 → 2HCl
Кроме того, водород может образовывать соединения с металлами, например, с натрием:
- 2Na + H2 → 2NaH
Водород также является важным компонентом многих органических соединений, таких как углеводороды. Наличие водорода в этих соединениях определяет их физические и химические свойства.
Таким образом, роль водорода в химических реакциях и образовании соединений необходима и важна для понимания и изучения многих аспектов химии и ее приложений.
Второе значимое соединение до водорода
Гелий обладает рядом уникальных свойств, делающих его важным в химических соединениях. Во-первых, он является инертным газом и практически не реагирует с другими элементами. Это свойство делает его безопасным для использования в различных областях, включая промышленные процессы и медицину.
Во-вторых, гелий обладает низкой плотностью, что делает его идеальным для использования в заполняющем газе воздушных шаров и дирижаблей. Также гелий используется в промышленности для создания контрольных газовых смесей и гелиевых аэрозолей.
Кроме того, гелий используется в научных исследованиях, в том числе в ядерной физике, а также в промышленности для сварки и резки металлов. Из-за своей низкой плотности и стабильности, гелий также используется в хранилищах данных, чтобы предотвратить перегрев и повреждение электроники.
Таким образом, гелий играет важную роль в различных сферах науки и промышленности, благодаря своим уникальным свойствам и возможностям. Его низкая реактивность и высокая стабильность делают его ценным и востребованным элементом в химических соединениях и технологических процессах.
Влияние на физические свойства
Стоящие до водорода элементы играют важную роль в определении физических свойств различных химических соединений. Эти элементы, такие как литий, натрий и калий, обладают низкими температурами плавления и кипения, что способствует образованию соединений с низкими точками плавления и кипения.
Например, в периоде третьем таблицы Менделеева, где располагаются элементы от натрия до аргон, плавление и кипение элементов возрастает с увеличением атомного номера. Это объясняется тем, что статическая зарядка ядра атома увеличивается с увеличением атомного номера, что приводит к более сильным силам притяжения между атомами и, следовательно, высоким температурам плавления и кипения.
Также стоящие до водорода элементы могут влиять на электрохимические свойства соединений. Это происходит из-за различной электроотрицательности элементов. Например, литий имеет наименьшую электроотрицательность среди всех химических элементов, а водород – вторую наименьшую. Поэтому, соединения водорода с такими элементами, как литий и натрий, обладают высокой электроотрицательностью.
Третье химическое соединение до водорода
Третье соединение до водорода является одним из ключевых компонентов в процессе синтеза аммиака и азотной кислоты, которые чрезвычайно важны в химической промышленности. Эти соединения используются в производстве удобрений, пластиков, взрывчатых веществ и других многих продуктов.
Кроме того, третье химическое соединение до водорода может также играть роль в катализаторах, облегчая многие химические реакции. Оно может быть введено в различные соединения, чтобы изменить их свойства и поведение.
В целом, третье химическое соединение до водорода имеет значительное значение в химической промышленности и играет важную роль в многих процессах и реакциях.
Взаимодействие с другими элементами
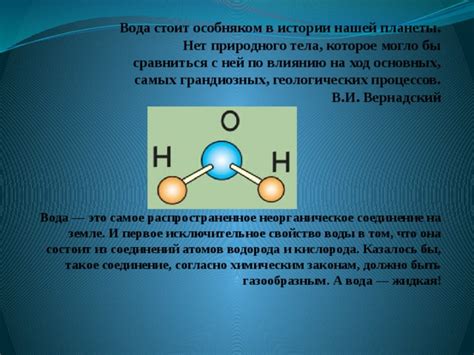
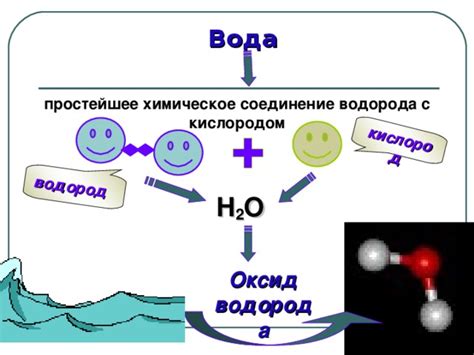
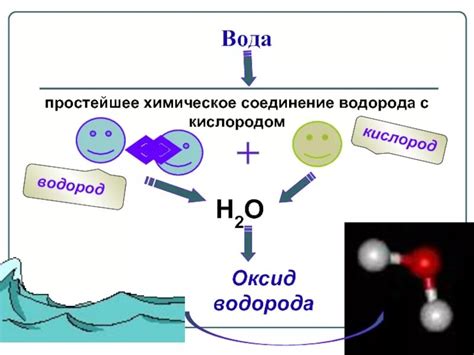
Самое известное химическое соединение водорода - вода. Водород образует соединение с кислородом, в результате чего образуется вода - одно из самых важных соединений для жизни на Земле. Вода является не только основным составным элементом живых организмов, но также играет важную роль во многих химических реакциях и процессах.
Водород также образует соединения с элементами группы 17 - галогенами (хлором, бромом, йодом). В результате образуются соединения, известные как водородные галогены. Эти соединения обладают высокой реактивностью и являются важными компонентами многих промышленных процессов.
Водород может также образовывать соединения с многими металлами, в результате образуя металлогидриды. Эти соединения могут быть использованы как хранители и переносчики водорода.
Также водород может образовывать соединения с неметаллами, такими как углерод, азот и сера. Например, водород и азот образуют аммиак, используемый в производстве удобрений. Водород также может образовывать соединения с неорганическими и органическими соединениями, играющими важную роль во многих химических реакциях и процессах.
Четвертое важное соединение до водорода

Метан является главным компонентом природного газа и используется в качестве топлива. Он широко используется в промышленности, зажигаясь и создавая большое количество тепла.
Метан также является продуктом биологического разложения органического вещества в безкислородных условиях. Он образуется при гниении органических веществ в магмах и почве, а также при переработке отходов и внутрижелудочных процессах животных.
Помимо этого, метан является потенциальным источником энергии. Он может использоваться в качестве альтернативного источника энергии, так как его сжигание намного менее вредно для окружающей среды по сравнению с другими ископаемыми топливами.
Роль в биологических процессах
Одной из важных функций водорода является его участие в процессе дыхания. Водородные ионы (H+) являются необходимыми для генерации энергии в митохондриях, где происходит окисление органических веществ. Водородные ионы переносятся в митохондрии с помощью белковых носителей, таких как НАД и ФАД, и участвуют в цепи дыхательных ферментов, где генерируется АТФ - основной источник энергии для клеток.
Кроме того, водород играет роль в процессе фотосинтеза. В растениях вода расщепляется на атомы водорода и кислород при использовании энергии солнечного света. Атомы водорода служат источником электронов для синтеза органических молекул, таких как углеводы и жиры, которые являются основными компонентами пищи для живых организмов.
Более того, водородное связывание, где атомы водорода образуют слабые связи с другими атомами, является важной составляющей молекул белка и ДНК. Водородные связи стабилизируют структуру белков и ДНК, обеспечивая их правильное складывание и функционирование в клетках.
Таким образом, водород играет значительную роль в биологических процессах, участвуя в процессах дыхания, фотосинтеза и стабилизации биологических молекул. Его присутствие и взаимодействие с другими атомами и молекулами в организмах необходимо для обеспечения жизнедеятельности и поддержания основных биологических функций.








