Нейтральные атомы - это атомы, у которых число электронов равно числу протонов в ядре. Они являются основными строительными блоками вещества и представляют собой наименьшие единицы химических элементов.
В отличие от ионов, которые имеют положительный или отрицательный заряд из-за недостатка или избытка электронов, нейтральные атомы не имеют заряда и являются электрически нейтральными. Они обладают равным количеством положительных и отрицательных зарядов, что обеспечивает их стабильность и инертность.
Свойства нейтральных атомов определяются их электронной конфигурацией. Электроны располагаются в различных энергетических уровнях, образуя электронные оболочки. Внешняя оболочка, называемая валентной, определяет химические свойства атома и его способность вступать в химические реакции.
Нейтральные атомы проявляют свойства, такие как валентность, атомный радиус, электроотрицательность, их способность образовывать молекулы и кристаллы. Они могут соединяться с другими атомами путем обмена, приобретения или потери электронов, образуя химические связи и образцы соединений, таких как соли, кислоты, щелочи и многое другое.
Понимание нейтральных атомов является основой для изучения химии, физики и других естественных наук. Их свойства и особенности помогают объяснить широкий спектр явлений, от состояния вещества до химических реакций и строения материи в микромире.
Нейтральные атомы: определение и понятие
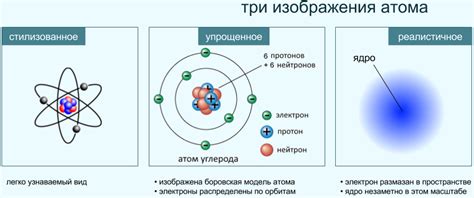
Основные свойства нейтральных атомов:
- Нейтральные атомы обладают стабильной структурой, поскольку число электронов совпадает с числом протонов, и силы притяжения и отталкивания сбалансированы.
- Нейтральные атомы могут образовывать соединения с другими атомами, обмениваясь или передавая электроны. Это обуславливает их роль в химических реакциях и образовании различных веществ.
- Нейтральные атомы могут находиться в разных энергетических состояниях или обладать различной валентностью, что определяется количеством электронных оболочек и отношением betweentheX[local_binding_type].
Нейтральные атомы являются основными строительными блоками веществ и обладают различными свойствами, которые определены их структурой и взаимодействием с другими атомами. Изучение нейтральных атомов и их химических свойств позволяет лучше понять основы химии и реакции, которые происходят между различными веществами.
Что такое нейтральные атомы?
Нейтральные атомы являются основными строительными блоками вещества и являются основой химических реакций. Они представляют собой стабильную форму вещества и не обладают ни положительным, ни отрицательным электрическим зарядом.
Нейтральные атомы обычно образуются при соединении атомов разных элементов в химических реакциях. Например, при образовании молекулы воды один атом кислорода соединяется с двумя атомами водорода, образуя нейтральные атомы воды.
Нейтральные атомы имеют свойства и особенности, определяющие их химическое поведение и роль в природе. Например, обмен электронами между нейтральными атомами приводит к образованию химических связей и образованию соединений. Также нейтральные атомы могут претерпевать различные химические реакции, влияя на свойства и состояние вещества.
Структура и свойства нейтральных атомов

Атом представляет собой электронейтральную систему, где количество протонов в ядре равно количеству электронов в оболочке. За счет взаимодействия между протонами и электронами, атомы обладают стабильностью.
Основные свойства нейтральных атомов включают:
- Масса атома – сумма масс протонов и нейтронов в ядре атома. Стабильные атомы имеют практически постоянную массу.
- Заряд атома – нейтральные атомы имеют нулевой заряд, так как количество протонов равно количеству электронов.
- Радиус атома – расстояние от центра ядра до наружного электрона в атоме. Размер атома может варьироваться в зависимости от его типа и состояния.
- Электронная конфигурация – распределение электронов по энергетическим уровням и орбиталям в атоме.
Нейтральные атомы обладают структурой, которая позволяет им формировать химические связи с другими атомами и образовывать бесчисленное множество соединений. Эти связи между атомами определяют химические и физические свойства вещества.
Структура атома и его особенности
Электроны - это негативно заряженные элементарные частицы. Они обращаются по энергетическим уровням вокруг ядра атома. Энергетические уровни представляют собой области пространства, где электроны могут находиться с определенной энергией. Количество электронов на каждом уровне ограничено и может быть определено с помощью формулы 2n², где n - номер энергетического уровня.
Протоны - это положительно заряженные элементарные частицы, которые находятся в ядре атома вместе с нейтронами. Количество протонов определяет химические свойства элемента и называется атомный номер. Например, у всех атомов углерода атомный номер равен 6.
Нейтроны - это элементарные частицы, которые находятся в ядре атома вместе с протонами. Они не имеют электрического заряда, поэтому не влияют на химические свойства элемента. Количество нейтронов в атоме может быть разным, и варианты с разным количеством нейтронов называются изотопами. Изотопы одного элемента имеют одинаковое количество протонов, но разное количество нейтронов.
Структура атома определяет его химические и физические свойства. Взаимодействие электронов с другими атомами определяет способность атомов образовывать связи и образование различных химических соединений.
Электроны и их роль в нейтральном атоме

Количество электронов в атоме обычно равно количеству протонов в ядре, что делает атом нейтральным по заряду. Однако, в некоторых случаях атом может иметь большее или меньшее количество электронов, и это приводит к образованию ионов - заряженных частиц.
Электроны располагаются в разных энергетических уровнях или оболочках вокруг ядра. Каждая оболочка может содержать определенное количество электронов. Внутренние оболочки, ближе к ядру, могут содержать меньшее количество электронов, в то время как внешняя оболочка может содержать большее количество.
Распределение электронов по оболочкам определяется электронной конфигурацией атома. Электроны могут изменять свое расположение в оболочках при взаимодействии с другими атомами, образуя химические связи и участвуя в химических реакциях.
Электроны также определяют химические свойства атома. Их расположение и энергетическое состояние влияют на способность атома образовывать химические связи и взаимодействовать с другими атомами. Количество электронов во внешней оболочке, называемой валентной оболочкой, определяет химическую активность атома.
В целом, электроны играют ключевую роль в определении химических и физических свойств нейтральных атомов. Их распределение и взаимодействие с другими атомами формируют основу химии и позволяют атомам образовывать соединения и молекулы.
Энергетические уровни и оболочки
Энергетические уровни атома представляют собой дискретные значения энергии, которые электроны могут принимать. Каждый энергетический уровень имеет определенную энергию, и электроны находятся на разных уровнях в зависимости от их энергии.
Оболочки атома представляют собой группы энергетических уровней с одинаковой энергией. На первой оболочке может находиться не более 2 электронов, на второй - не более 8, на третьей - не более 18 и т. д. Оболочки располагаются вокруг ядра атома и описывают траектории движения электронов.
Внешняя оболочка атома, называемая валентной оболочкой, играет особую роль. Именно электроны на валентной оболочке определяют химические свойства атома и его способность вступать в химические реакции с другими атомами.








