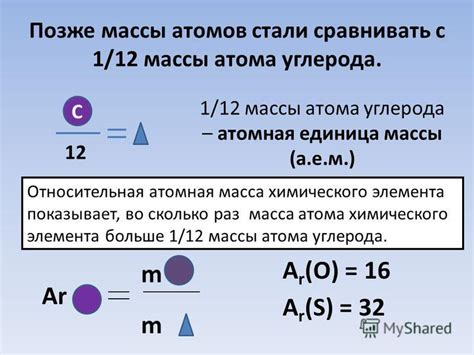
Масса атома – это характеристика атома, которая определяет его массу в сравнении с массой других атомов. Масса атома измеряется в атомных единицах массы (а.е.м) и позволяет установить относительную массу какой-либо частицы.
Атомная массовая единица является одной двенадцатой массы атома углерода-12 и равна приблизительно 1.66×10^−27 кг. Именно в атомных единицах массы указываются массы элементов, веществ и реакций в химии и физике.
Определение массы атома происходит на основе экспериментальных данных, полученных с помощью различных методов, включая масс-спектрометрию и изотопический анализ. Процесс измерения массы атома связан с точностью и вниманием к мельчайшим деталям, поскольку масса атома является фундаментальной характеристикой для изучения микромира.
Масса атома играет важную роль в химии, физике и других науках. Она определяет свойства вещества, его реакционную способность, а также формулировку физических законов. Исследование масс атомов поможет расширить наши знания о строении и функционировании микромира, открывая новые возможности для разработки новых технологий и материалов.
Масса атома: понятие и значимость

Понятие массы атома
Масса атома измеряется в атомных единицах массы (а.е.м.) или в килограммах. В атомной физике используется единая массовая константа - масса одного атома углерода-12, равная приблизительно 1,66 х 10^-27 кг или 1 а.е.м. Она принята за единицу массы атома, и все другие массы атомов выражаются относительно нее.
Значимость массы атома
Знание массы атома позволяет определить другие параметры атома, такие как молярная масса, число атомов в веществе, молярная концентрация и другие. Также масса атома является ключевой характеристикой для понимания процессов ядерного распада, химических реакций и реакций с электромагнитными полями.
Определение массы атома является важной задачей в атомной физике и химии. Современные методы позволяют определять массу атома с высокой точностью и стабильностью, что необходимо для развития различных областей науки и технологии.
Определение массы атома
Чтобы определить массу атома, необходимо знать его атомный номер, который указывает на количество протонов в ядре. Например, для атома натрия атомный номер равен 11. Для определения массы атома натрия нужно учесть не только протоны, но и нейтроны, которых в ядре может быть разное количество.
Масса атома вычисляется с использованием таблицы химических элементов, где для каждого элемента указана его атомная масса. Атомная масса измеряется относительно одной двенадцатой части массы атома углерода-12. Таким образом, масса атома углерода-12 равна примерно 12 а.е.м.
| Элемент | Атомный номер | Атомная масса |
|---|---|---|
| Водород | 1 | 1.008 а.е.м. |
| Кислород | 8 | 16.00 а.е.м. |
| Углерод | 12 | 12.01 а.е.м. |
| Натрий | 11 | 22.99 а.е.м. |
| Железо | 26 | 55.85 а.е.м. |
Таким образом, масса атома натрия составляет примерно 22.99 а.е.м. Для других элементов массу атома можно определить аналогичным образом.
Зависимость массы атома от состава

Состав атома определяется числом протонов в его ядре, которое также называется атомным номером и обозначается символом Z. Протоны – положительно заряженные частицы, их количество определяет химические свойства элемента. Нейтроны – нейтральные частицы, их наличие в ядре атома никак не влияет на его химические свойства.
Масса протона – примерно 1.0073 а.е.м., масса нейтрона – около 1.0087 а.е.м., а масса электрона – очень незначительная и считается пренебрежимо малой. Из-за этого, масса атома в основном зависит от состава его ядра, где находятся протоны и нейтроны, в то время как электроны сравнительно не влияют на массу.
Измерение массы атома: основные методы
- Химический метод: этот метод основан на химических реакциях между различными элементами. Исходя из закона сохранения массы, можно определить массу атома, исследуя массу продуктов реакции. Например, при изучении реакции образования воды можно определить массу кислорода и водорода, исходя из которых можно найти массу атома кислорода и водорода.
- Спектроскопический метод: этот метод основан на анализе электромагнитного излучения, испускаемого или поглощаемого атомами. При проведении спектрального анализа можно определить энергию, частоту или длину волны излучения, что позволяет вычислить массу атома. Масс-спектрометрия является одним из наиболее точных и распространенных методов спектроскопического анализа.
- Физический метод: этот метод основан на использовании различных физических явлений и принципов, связанных с массой атомов. Например, массу атома можно определить методами, основанными на использовании радиоактивности, эффекта Доплера, принципа действия и противодействия и других физических законов и явлений.
Каждый из перечисленных методов имеет свои преимущества и ограничения. Выбор метода измерения массы атома зависит от характеристик исследуемого элемента и поставленных целей эксперимента. Современные методы измерения массы атома позволяют достичь высокой точности и надежности результатов, что играет важную роль в дальнейшем развитии научных исследований и применении результатов в практике.
Роль массы атома в химических реакциях

Масса атома играет важную роль в химических реакциях. Когда два или более атома вступают в химическую реакцию, масса каждого атома определяет его вклад в общую массу реагирующих веществ и продуктов реакции.
Масса атома определяется суммой массы его протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома и имеют почти одинаковую массу, но протоны имеют положительный заряд, а нейтроны – нейтральный. Масса электронов пренебрежимо мала по сравнению с массой протонов и нейтронов.
Когда происходит химическая реакция, вещества превращаются в продукты путем перестройки атомов и связей между ними. При этом масса остается неизменной – закон сохранения массы. Это означает, что общая масса реагирующих веществ равна общей массе продуктов реакции.
Масса атомов в реагирующих веществах и продуктах реакции играет важную роль при расчете количества веществ, участвующих в реакции. По массе веществ можно определить их количество, используя концепцию молярной массы. Молярная масса – это масса вещества, выраженная в единицах моля. Она равна массе одного моля вещества и измеряется в г/моль.
Таким образом, знание массы атома и его вклада в общую массу реагирующих веществ позволяет понять, как изменяется состав реагирующих веществ и продуктов реакции, а также провести расчеты количества веществ, участвующих в химической реакции.
Масса атома и единицы измерения
Основной единицей измерения массы атома является атомная единица массы (а.е.м.). Она эквивалентна 1/12 массы атома углерода-12, и ее значение составляет примерно 1,66054 × 10^−24 г. Атомная единица массы является наиболее удобной для выражения массы атомов, так как позволяет оперировать целыми и десятичными числами, не требуя больших числовых значений.
Кроме атомной единицы массы, существуют и другие единицы измерения массы атомов, такие как дальтон (Да) и килограмм (кг). Дальтон – это единица массы, которая равна 1/12 массы атома углерода-12, и ее значение составляет примерно 1,66054 × 10^−27 кг. Килограмм – это международная система единиц SI, в которой масса атома углерода-12 составляет примерно 1,99264 × 10^−26 кг.
Для проведения точных измерений массы атомов используются различные методы, включая масс-спектрометрию и использование массовых спектрометров. Эти методы позволяют получать точные значения масс атомов различных элементов, что является важным для научных и технических исследований в области химии, физики и других наук.
Применение массы атома в научных и промышленных областях
Масса атома, также известная как атомная масса или атомный вес, играет ключевую роль во многих научных и промышленных областях. Разумение и определение массы атома имеет решающее значение для многих процессов и исследований, связанных с атомами и химическими реакциями.
1. Химия: Масса атома является основой для многих химических расчетов и реакций. Она используется для определения молекулярной массы соединений и элементов. Знание массы атома позволяет химикам определить количество реагентов, необходимых для проведения реакции, и прогнозировать итоговые продукты реакции.
2. Физика: В физике масса атома используется для расчета энергетических процессов и определения свойств материалов. Она также является важной характеристикой элементарных частиц, таких как электроны, протоны и нейтроны. Масса атома используется в ряде физических формул и уравнений, связанных с механикой, термодинамикой и ядерной физикой.
3. Биология: В биологических исследованиях масса атома важна для изучения структуры и функции биомолекул, таких как ДНК, РНК и белки. Знание массы атома позволяет биологам определять последовательность аминокислот в белках и сравнивать структуры молекул для анализа их функций.
4. Промышленность: Масса атома важна в целом ряде промышленных процессов и приложений. Например, она используется в синтезе новых материалов, производстве лекарственных препаратов, разработке новых электронных устройств и улучшении производительности топлива.
| Применение | Область |
|---|---|
| Химия | Определение молекулярной массы, расчеты реакций |
| Физика | Расчет энергетических процессов, характеристики элементарных частиц |
| Биология | Изучение структуры биомолекул, анализ функций |
| Промышленность | Синтез новых материалов, производство лекарств, электроника, разработка топлива |
Определение и использование массы атома имеет широкий спектр применений и играет важную роль в различных научных и промышленных областях. Без понимания массы атома было бы трудно достичь высокой точности во многих исследованиях и разработках, связанных с атомами и молекулами.








