Белки являются одними из основных молекул в клетках живых организмов и выполняют широкий спектр функций, от поддержания структуры клетки до участия в каталитических реакциях и передаче генетической информации. Вторичная структура белка играет ключевую роль в определении их функций и свойств.
Вторичная структура белка представляет собой трехмерное пространственное расположение аминокислот в молекуле белка. Наряду с первичной структурой (последовательность аминокислот) и третичной структурой (общая пространственная конформация молекулы белка), вторичная структура является одним из основных уровней организации белка.
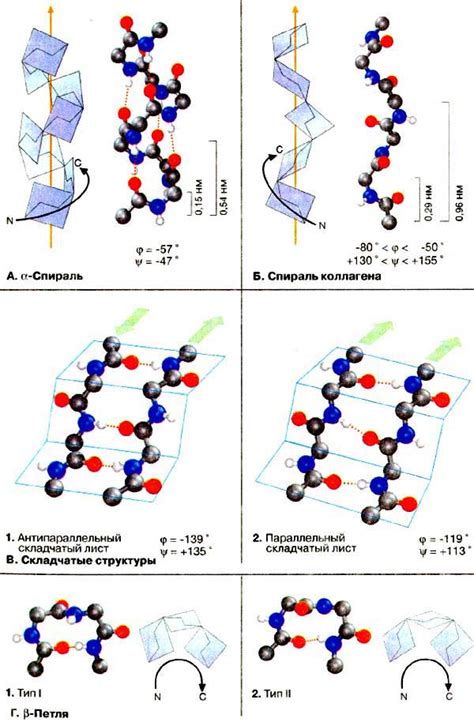
Вторичная структура белка образуется благодаря взаимодействию свободных аминокислотных остатков между собой, которые могут формировать различные упорядоченные участки, такие как спираль альфа и лист протяженности бета. Эти упорядоченные структуры образуются за счет водородных связей между аминокислотами, которые устойчивы и поддерживаются в условиях физиологических температур и pH.
Вторичная структура белка имеет важное значение для его функции, поскольку она определяет физические и химические свойства белка. Например, спираль альфа может играть роль в формировании центра активности белка, а лист протяженности бета может быть вовлечен в формирование структуры, необходимой для связывания других молекул.
Понимание вторичной структуры белка является ключевым для понимания их функциональных свойств и взаимодействий с другими молекулами. Исследования в этой области позволяют разрабатывать новые лекарственные препараты и улучшать существующие методы диагностики и лечения различных заболеваний.
Что такое вторичная структура белка?
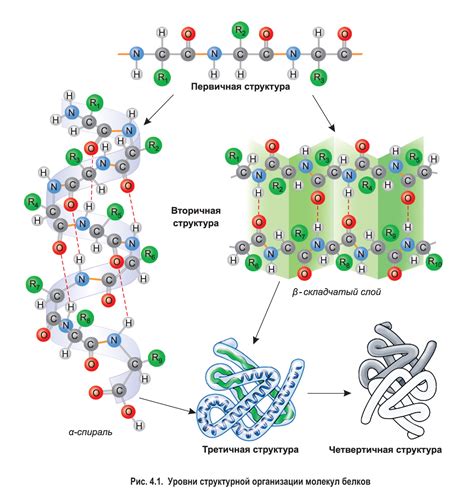
Наиболее распространенными формами вторичной структуры являются alpha-спираль и бета-складка. Alpha-спираль представляет собой спиральную форму, образованную поворотом полипептидной цепи вокруг своей оси. Бета-складка представляет собой сгиб полипептидной цепи в структуре "складки", образованной параллельными или антипараллельными линиями H-связи между аминокислотными остатками.
Вторичная структура белка обеспечивает его трехмерную форму и стабильность. Взаимодействие аминокислотных остатков внутри вторичной структуры формирует гидрофобные ядра и гидрофильные поверхности белка, что влияет на его взаимодействие с другими молекулами и регулирует его функциональность. Отличия во вторичной структуре могут играть роль в формировании свойств белка, его активности и специфичности.
Исследование вторичной структуры белка является важной задачей в молекулярной биологии и биохимии. Существуют различные методы для определения вторичной структуры, включая рентгеноструктурный анализ, ядерный магнитный резонанс (ЯМР) и спектроскопию инфракрасного поглощения. Эти методы позволяют уточнить трехмерную структуру белка и проанализировать его функциональные свойства.
Значение вторичной структуры белка в биологии
Вторичная структура белка играет важную роль в биологии и имеет несколько значимых функций:
- Создание стабильной пространственной конформации.
- Обеспечение устойчивости и стойкости белков.
- Участие в белковом свертывании.
- Участие в белковых взаимодействиях.
Вторичная структура белков, в основном альфа-спирали и бета-складки, формирует определенную пространственную конформацию молекулы. Это позволяет белкам выполнять свою функцию эффективно и эффективно в клетке.
Вторичная структура белка обеспечивает устойчивость и стойкость молекулы к различным физическим и химическим факторам, таким как высокие температуры или изменения pH. Это позволяет белкам сохранять свою функциональность в условиях изменяющейся среды.
Вторичная структура белка играет важную роль в процессе его свертывания. Она помогает определить правильное пространственное расположение остатков аминокислот и способствует образованию третичной структуры.
Вторичная структура белка может также играть роль в его взаимодействии с другими молекулами, включая другие белки и лиганды. Она может образовывать определенные участки, которые могут связываться с другими молекулами, что влияет на функциональность белка в клетке.
Таким образом, вторичная структура белка имеет большое значение в биологии, определяя его функциональность, устойчивость и взаимодействие в клетке.
Главные типы вторичной структуры белка:
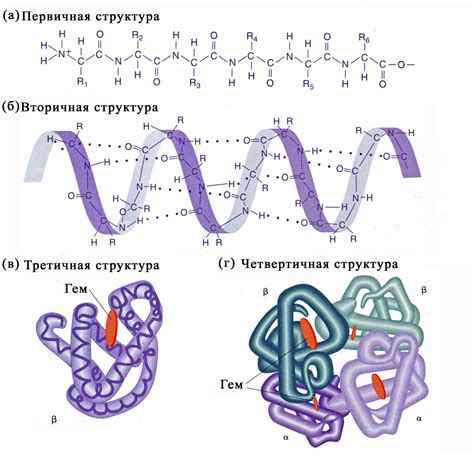
2. Бета-складка (бета-лист) – это листовидная структура, образованная параллельными или антипараллельными полипептидными цепями, связанными друг с другом водородными связями. Бета-ленты протяженны, пронизывают глубину белка и взаимосвеязаны друг с другом.
3. Повернутая бета-складка – это структура, при которой направление пептидных связей возрастает по часовой стрелке. Они формируются в результате загиба плоскости бета-листа.
4. Мотив развилки (также известный как развилка Ричардсона) – это структурный элемент белка, состоящий из двух сегментов, соединенных "развилкой". Они могут быть простыми, в виде лестницы или сложными, со сложными ветвлениями и поворотами.
5. Граница бета-листа – это место, где бета-лист "сгибается" и переходит в другой тип вторичной структуры, такой как альфа-спираль или повернутая бета-складка.
Примеры белков с различными типами вторичной структуры
Вторичная структура белка может принимать различные формы, включая α-спираль, β-складку, π-спираль, 310-спираль, γ-спираль и другие. Ниже приведены примеры белков, которые обладают разными типами вторичной структуры:
- Миоглобин - белок, содержащий α-спираль и β-складку. Такая комбинация вторичной структуры позволяет миоглобину выполнять свою основную функцию - транспортировку и хранение кислорода в мышцах.
- Иммуноглобулин - белок антитела, содержащий многочисленные β-складки. Благодаря своей вторичной структуре иммуноглобулины могут специфически связываться с антигенами и вызывать иммунный ответ организма.
- Коллаген - белковый компонент соединительной ткани, обладающий уникальной структурой - тройной спиралью. Это особенная форма вторичной структуры, которая обеспечивает коллагену прочность и упругость.
- Фибриноген - белок, играющий ключевую роль в процессе свертывания крови. У него есть множество α-спиралей и β-складок, формирующих его функциональную структуру.
Это только некоторые примеры белков с различными типами вторичной структуры. Каждый тип структуры имеет свою уникальную функцию и влияет на свойства и активность белка.
Методы определения вторичной структуры белка
Вторичная структура белка представляет собой пространственное расположение аминокислотных остатков внутри молекулы. Для определения вторичной структуры существуют различные методы, позволяющие получить информацию о пространственной организации белка.
1. Рентгеноструктурный анализ
Один из основных методов определения вторичной структуры белка - это рентгеноструктурный анализ. Этот метод основан на рассеянии рентгеновских лучей белковыми кристаллами. Благодаря этому методу можно получить точную информацию о координационных связях и углах между атомами, что позволяет определить вторичную структуру белка.
2. Ядерный магнитный резонанс (ЯМР)
Ядерный магнитный резонанс является мощным методом определения структуры белка, включая вторичную структуру. Этот метод основан на взаимодействии ядер с магнитным полем и позволяет изучать конформацию белковых цепей. ЯМР спектры белка могут содержать информацию о структурных мотивах и взаимодействиях между аминокислотными остатками.
3. Круговой дихроизм
Круговой дихроизм является узким спектральным методом, который позволяет определить вторичную структуру белка на основе изменения показателя поглощения света. Этот метод основан на хиральности вторичной структуры белка и его взаимодействия с поляризованным светом.
4. Инфракрасная спектроскопия
Инфракрасная спектроскопия использует изменение спектра инфракрасного излучения при прохождении через белковые образцы. Этот метод позволяет определить наличие специфических групп атомов, характерных для вторичной структуры белка.
Определение вторичной структуры белка является важной задачей в биохимии и структурной биологии. Комбинация различных методов позволяет получить полную и точную информацию о пространственной организации белка, что необходимо для его дальнейшего изучения и понимания его функций.
Роль вторичной структуры белка в его функциональности
Вторичная структура белка играет важную роль в его функциональности. Белки имеют уникальную способность складываться в определенные вторичные структуры, такие как α-спираль, β-лист или β-волокно.
Эти вторичные структуры обеспечивают стабильность и прочность белка, а также позволяют ему выполнять свои функции в организме. Например, некоторые вторичные структуры образуют активные центры ферментов, которые катализируют химические реакции в организме.
Вторичная структура также определяет взаимодействие белков с другими молекулами, такими как ДНК, РНК или другие белки. Она может обеспечивать связывание молекул в определенной конформации или расположении, что позволяет совершать сложные биологические процессы, такие как передача сигналов или транспорт молекул внутри клетки.
Кроме того, вторичная структура белка влияет на его степень растворимости в воде. Некоторые вторичные структуры делают белок гидрофобным, что позволяет ему связываться с мембранами клеток или другими гидрофобными молекулами.
Таким образом, вторичная структура белка является ключевым элементом его функциональности и влияет на его способность выполнять различные биологические функции в организме.
Влияние изменений во вторичной структуре на свойства белка
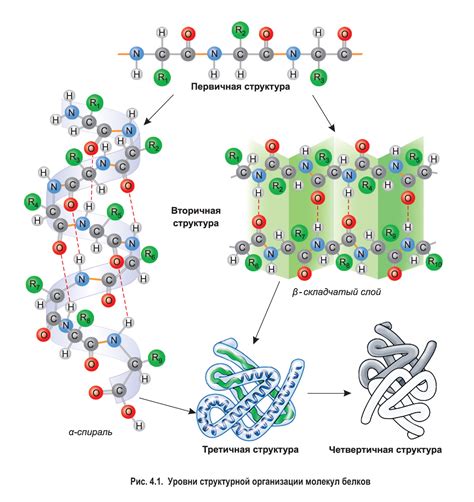
Вторичная структура белка представляет собой пространственную организацию аминокислотных остатков внутри полипептидной цепи. Она формируется благодаря взаимодействию между C=O и N-H группами в белке, что приводит к образованию спиралей (альфа-спираль) и прямых цепочек (бета-складки). Изменения во вторичной структуре белка могут сильно влиять на его свойства и функции.
Одно из главных свойств белка, которое может зависеть от его вторичной структуры, это его устойчивость к температуре и химическим воздействиям. Структурные изменения, такие как нарушение альфа-спиралей или разрывы бета-складок, могут привести к потере стабильности белка и его денатурации. При этом белок теряет свою функциональность и может стать неактивным.
Также, изменения во вторичной структуре белка могут влиять на его взаимодействие с другими молекулами. Например, области белка, содержащие альфа-спирали или бета-складки, могут быть ключевыми взаимодействующими участками для связывания с другими белками, лигандами и ДНК. Изменения в этих областях могут повлиять на способность белка связываться с соответствующими молекулами и, следовательно, на его функцию.
Кроме того, изменения во вторичной структуре белка могут приводить к его агрегации и образованию амилоидных отложений. Амилоидные отложения являются основной причиной различных невродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона. Это происходит из-за неправильной организации вторичной структуры белка, что приводит к его накоплению и образованию структурных аномалий.
Таким образом, изменения во вторичной структуре белка могут иметь серьезные последствия для его функции и структурных свойств. Изучение влияния таких изменений на свойства белков позволяет получать более глубокое понимание их функциональности и способствует разработке новых методов лечения различных заболеваний, связанных с нарушением вторичной структуры белков.
Вторичная структура белка и его взаимодействие с другими молекулами
Вторичная структура белка играет важную роль в его функционировании и взаимодействии с другими молекулами. Например, α-спираль может образовывать гидрофобные ямки, в которые встраиваются лиганды, такие как малые органические молекулы или другие белки. Это позволяет белку выполнять функции связывания и передачи сигналов в клетке.
β-складка, в свою очередь, может образовывать гидрофильные карманы, которые позволяют белку связывать молекулы воды или ионы. Это может быть важно, например, для обеспечения структурной устойчивости белка или его функции в переносе электронов.
Кроме своей роли в молекулярном распознавании и связывании, вторичная структура белка также может участвовать в формировании третичной и кватернической структуры белка. Следовательно, понимание вторичной структуры белка существенно для понимания его общей функции и возможности его взаимодействия с другими молекулами.








