Атомы элементов могут быть описаны с помощью их электронной структуры, которая определяет их химические свойства. Ключевым аспектом электронной структуры являются энергетические уровни, на которых находятся электроны вокруг ядра атома. Один из важнейших энергетических уровней - это внешний энергетический уровень.
В каждом атому элемента есть несколько энергетических уровней, причем энергия этих уровней различается. Внешний энергетический уровень представляет собой самый высокий энергетический уровень в атоме, на котором находятся электроны с наибольшей энергией. Именно эти электроны обеспечивают химическую активность атома.
На внешнем энергетическом уровне атома элемента может находиться от 1 до 8 электронов, что определяет его химические свойства и способность к образованию химических связей с другими атомами. Элементы с полностью заполненным внешним энергетическим уровнем, например, инертные газы, обладают низкой химической активностью, так как у них нет электронов, которые могли бы участвовать в химических реакциях.
Элементы, у которых внешний энергетический уровень не полностью заполнен или полностью пуст, имеют высокую химическую активность и способность образовывать химические связи с другими элементами для достижения стабильной и более энергетически выгодной электронной конфигурации.
Внешний энергетический уровень атома элемента играет важную роль в определении его химических свойств и способности к реакциям с другими элементами. Понимание внешней электронной конфигурации атомов помогает установить закономерности в химии и предсказать химические свойства различных элементов.
Внешний энергетический уровень атома элемента и его химические свойства:
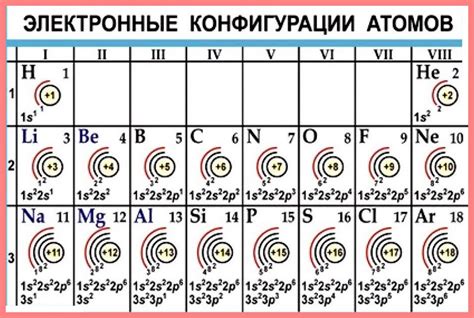
Количество валентных электронов в атоме элемента соответствует его порядковому номеру в таблице Менделеева. Например, у атома кислорода, который расположен в 16-й группе, шесть валентных электронов. Углерод, находящийся во 2-й группе, имеет четыре валентных электрона.
Валентные электроны расположены на внешнем энергетическом уровне, называемом "валентной оболочкой". Этот уровень находится на большей удаленности от ядра, в сравнении с внутренними энергетическими уровнями. Такая отдаленность делает валентные электроны доступными для взаимодействия с другими атомами.
Количество валентных электронов и их расположение на внешнем энергетическом уровне определяют химические свойства элемента. Атомы с полностью заполненными внешними оболочками обычно являются инертными и мало реактивными. Например, инертные газы - гелий и неон, имеют полностью заполненные внешние оболочки.
Валентные электроны могут быть перемещены или разделяться во время химических реакций. При образовании ковалентной связи электроны могут быть общими между двумя атомами, образуя молекулы. При образовании ионных связей, атом может отдать или получить один или несколько валентных электронов, образуя положительно или отрицательно заряженные ионы.
Знание количества валентных электронов и их поведения позволяет предсказывать возможные химические реакции и образование различных соединений. Это помогает определить свойства и использование элементов в различных областях, включая промышленность, медицину и электронику.
Значение внешнего энергетического уровня атома
Значение внешнего энергетического уровня атома играет важную роль в его химических свойствах. Электроны на внешнем энергетическом уровне определяют, каким образом атом будет участвовать в химических реакциях и какие связи он может образовывать с другими атомами.
Атомы стремятся заполнить свой внешний энергетический уровень, чтобы достичь наиболее стабильного состояния – состояния, близкого к конфигурации инертных газов, таких как гелий, неон и аргон. Для этого атомы могут принимать или отдавать электроны, образуя ионные связи, или делить электроны с другими атомами, образуя ковалентные связи.
Таким образом, внешний энергетический уровень атома элемента играет ключевую роль в определении его химических свойств. Он определяет, как атом будет реагировать с другими атомами и какие связи он может образовывать, что в конечном итоге определяет его химическую активность и возможность участия в различных химических реакциях.
Влияние внешнего энергетического уровня на химическую активность элемента
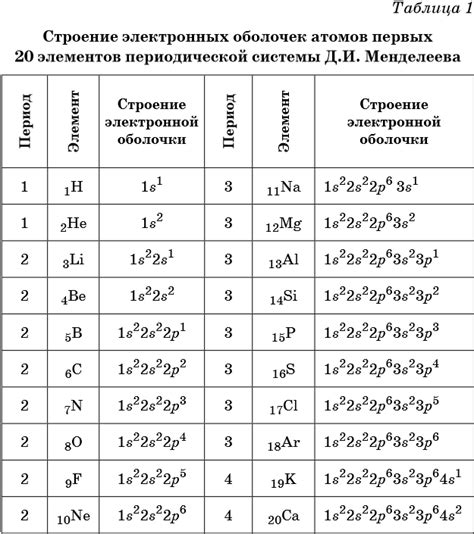
Внешний энергетический уровень атома элемента определяет его химическую активность и способность образовывать химические связи с другими атомами. Внешний энергетический уровень атома представляет собой последний энергетический уровень, на котором расположены внешние электроны.
Электроны на внешнем энергетическом уровне атома играют ключевую роль в химических реакциях. При контакте с другими атомами, эти электроны могут образовывать химические связи путем обмена, отдачи или приобретения электронов. Внешний энергетический уровень определяет, сколько электронов может принять или отдать атом, а также его склонность к образованию ионов.
Атомы с неполным внешним энергетическим уровнем обычно более реакционноспособны, так как они стремятся завершить энергетический уровень, чтобы достичь более стабильного состояния. Такие атомы обычно образуют химические связи с другими атомами, чтобы достичь структуры октаэдра с восемью электронами на внешнем энергетическом уровне.
Элементы, имеющие полный внешний энергетический уровень, обычно менее реакционноспособны, так как они уже достигли структуры октаэдра и не имеют потребности в образовании дополнительных химических связей. Это объясняет стабильность инертных газов, таких как гелий, неон, аргон и других элементов группы 18.
Таким образом, внешний энергетический уровень атома элемента играет важную роль в его химической активности и способности вступать в химические реакции.
Как внешний энергетический уровень определяет способы образования соединений
Количество электронов на внешнем энергетическом уровне называется валентностью атома. Число электронов на внешнем энергетическом уровне определяет способы взаимодействия этого атома с другими атомами и образования соединений.
Если атом имеет полностью заполненный внешний энергетический уровень, то он будет неактивен химически и образовывать соединения с трудом. Такие атомы более склонны образовывать ионы и устанавливать ионные связи с другими атомами для достижения стабильного состояния.
С другой стороны, если атом имеет неполностью заполненный внешний энергетический уровень, он будет активен химически и более легко образовывать соединения. Атомы с неполностью заполненными внешними энергетическими уровнями образуют связи с другими атомами путем обмена или совместного использования электронов, чтобы достичь стабильного состояния с полностью заполненным внешним энергетическим уровнем.
Важно отметить, что способы образования соединений также зависят от химического вида атома и его электронной конфигурации. Но в целом, внешний энергетический уровень является ключевым фактором, определяющим активность атома и его способы образования соединений.
Взаимодействие внешних энергетических уровней атомов при образовании химических связей
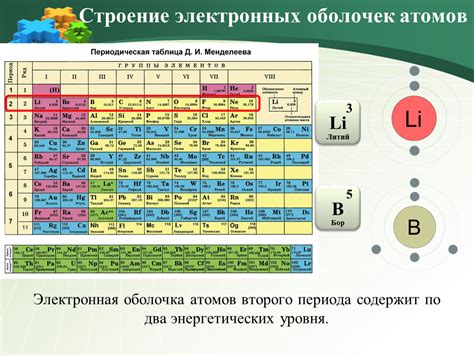
При образовании химических связей атомы вступают во взаимодействие, чтобы достичь более устойчивого состояния. В этом процессе внешние энергетические уровни атомов играют важную роль.
Когда два атома приближаются друг к другу, их внешние энергетические уровни начинают взаимодействовать. Если энергетические уровни совпадают или близки по энергии, то возникает возможность образования химической связи.
При образовании химической связи валентные электроны перераспределяются между взаимодействующими атомами, что приводит к изменению их электронной конфигурации. Атомы стремятся достигнуть наиболее устойчивой электронной конфигурации, заполнив свои внешние энергетические уровни. Для некоторых атомов это означает переход электронов с одного атома на другой, образуя ионную связь. Для других атомов происходит обмен электронами, образуя ковалентную связь.
Таким образом, взаимодействие внешних энергетических уровней атомов при образовании химических связей определяет стабильность и химические свойства соединения. Различия в энергетических уровнях могут привести к различным типам связей и определять реакционную активность вещества.
Внешний энергетический уровень и периодическая система элементов
Внешний энергетический уровень атома элемента определяет его химические свойства и влияет на его способность образовывать химические связи с другими атомами.
В периодической системе элементов атомы располагаются в порядке возрастания атомного номера и группируются в горизонтальные ряды, называемые периодами, и вертикальные столбцы, называемые группами.
Каждый элемент в периодической системе имеет определенное количество энергетических уровней. Внешний энергетический уровень атома элемента находится на самой внешней оболочке электронов. Эта оболочка называется валентной оболочкой и содержит внешние электроны, которые участвуют в химических реакциях атомов.
Свойства элементов внешний энергетический уровень определяют, так как именно валентные электроны определяют возможность атома образовывать химические связи с другими атомами. Внешний энергетический уровень может быть заполнен полностью или быть неполностью заполненным. Если он полностью заполнен, то элемент обладает высокой устойчивостью и низкой реакционной способностью. Если он неполностью заполнен, то элемент обладает более высокой реакционной способностью и может образовывать химические связи с другими элементами для достижения электронной конфигурации атома с полностью заполненной внешней оболочкой.
В периодической системе элементов внешние энергетические уровни атомов элементов повторяются периодически, что позволяет классифицировать элементы и предсказывать их химические свойства. Например, элементы, находящиеся в одной группе, имеют одинаковое количество внешних электронов и обладают схожими химическими свойствами. Это объясняет такие явления, как атомная радиус, химическая активность и способность образовывать ионные связи или ковалентные связи.








