Водородная связь является одним из наиболее важных и широко распространенных типов химических связей. Это особое взаимодействие между атомами, в котором водородный атом служит своеобразным мостиком, сращивающим два других атома. В результате образуется электростатическое взаимодействие, которое является свойственным для водородной связи и определяет ее уникальные свойства.
Водородная связь играет важную роль во многих химических процессах и системах. Она влияет на структуру и свойства многих веществ, включая молекулы воды, белков, нуклеиновых кислот и других биологически активных соединений. За счет водородной связи возникают сложные трехмерные структуры, которые определяют активность и функциональность этих соединений.
Важно отметить, что водородная связь обладает высокой энергией и прочностью, что делает ее структурным элементом в таких важных биологических процессах, как распознавание молекул, сворачивание белков и передача генетической информации. Также водородная связь играет важную роль в химической реактивности и катализе, позволяя ускорять или замедлять химические превращения.
Влияние водородной связи на химические связи и реакции
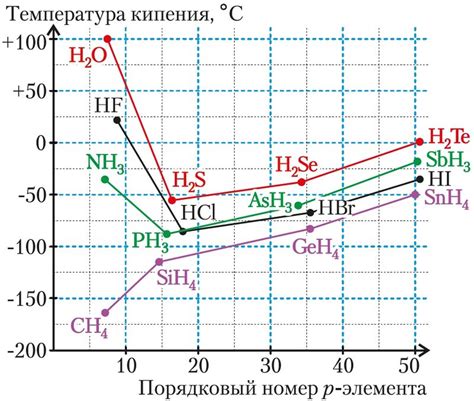
Водородная связь может оказывать влияние на химические связи между атомами. Она может изменить длину, энергию и углы химической связи. Водородная связь может стабилизировать молекулы и обеспечивать более прочные связи.
Водородная связь также играет важную роль в химических реакциях. Она может ускорять реакции, катализировать процессы и повышать эффективность реакций. Водородная связь может изменять энергетику реакций и влиять на скорость и направленность химических превращений.
Водородная связь имеет большое значение в биологии, поскольку она способна управлять структурой и функцией биологических молекул. Например, водородная связь между аминокислотами может определять структуру белков и их активность. Водородная связь также играет важную роль в формировании двойной спирали ДНК.
В итоге, влияние водородной связи на химические связи и реакции может быть очень значимым. Оно может изменять свойства веществ, управлять биологическими процессами и повышать эффективность химических реакций. Изучение водородной связи является важной областью современной химии и биологии.
Определение и особенности водородной связи
Водородные связи существуют во множестве химических соединений, играя ключевую роль в множестве биологических и химических процессов. Например, водородная связь имеет важное значение в стабилизации структуры ДНК, белков и других молекул, а также в определении физических и химических свойств вещества.
Основные особенности водородной связи:
| Особенность | Описание |
|---|---|
| Отрицательное направление | Атом водорода притягивается к атому электроотрицательного элемента. |
| Переносимость | Водородная связь может образовываться и разрушаться в различных химических соединениях. |
| Слабая сила связи | Водородные связи относительно слабые, но при этом обладают значительной энергией. |
| Ориентация | Водородная связь обладает определенной ориентацией, что определяет ее специфичность и селективность. |
Благодаря особенностям водородной связи, эта форма химического взаимодействия играет важную роль в понимании множества биологических и химических феноменов. Ее свойства и возможности активно исследуются в научной области, а также находят применение в различных сферах технологии и промышленности.
Физическое проявление водородной связи
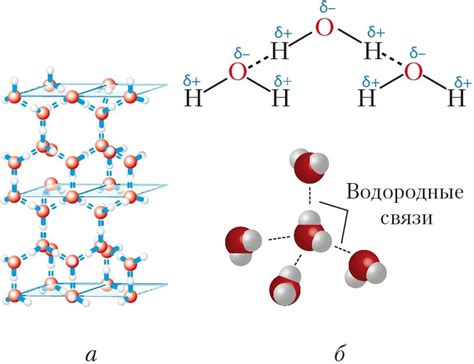
1. Высокая электроотрицательность:
Атом водорода является электроотрицательным, что позволяет ему привлекать электроны других атомов или молекул. Это позволяет образовывать водородные связи с электроотрицательными элементами, такими как кислород, азот, фтор и другие.
2. Короткая и сильная связь:
Водородная связь обладает особенно короткой длиной и сильными электростатическими силами притяжения, которые приводят к образованию стабильной связи между атомами или молекулами. Это является причиной уникальных свойств веществ, образующих водородные связи, таких как высокая температура кипения и плавления, а также высокая вязкость.
3. Ориентационное влияние:
Водородная связь оказывает ориентационное влияние на молекулы, структуры и реакции вещества. Она может определять форму молекулы и ее конформацию, а также протекание химических реакций и процессов. Это свойство играет важную роль в биологических системах, таких как сворачивание белков и взаимодействие между молекулами ДНК.
Водородная связь имеет фундаментальное значение в химии и биологии, и ее изучение позволяет лучше понять механизмы химических взаимодействий и свойства молекул и веществ.
Доноры и акцепторы водородной связи
Донор водородной связи - это атом водорода, который может передать свой валентный электронный пар акцептору. Для того чтобы атом водорода мог выступать в качестве донора водородной связи, он должен быть связан с атомом электроотрицательного элемента через однопродольный аод или ковалентную связь.
Акцептор водородной связи - это атом, который принимает пару электронов от донора. Электроотрицательный атом, который обладает свободной электронной парой направленной в сторону донорной связи, может быть акцептором водородной связи. Атомы кислорода и азота обладают свободными парами электронов и часто выступают в качестве акцепторов водородной связи.
Водородная связь влияет на множество химических взаимодействий, включая свойства веществ, как солей, кислот, оснований и водорастворимых органических соединений. Водородные связи также играют ключевую роль в структуре многих биологических молекул, таких как ДНК, РНК и белки.
Взаимодействие водородной связи с другими силами
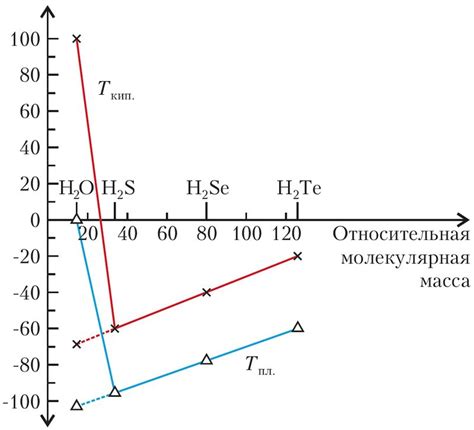
Водородная связь может взаимодействовать с другими силами и взаимодействиями, такими как ван-дер-Ваальсовы силы и ионные связи.
Ван-дер-Ваальсовы силы - слабые межмолекулярные силы, которые возникают из-за неравномерного распределения электронной плотности в молекуле. Водородные связи могут усиливать или ослаблять ван-дер-Ваальсовы силы в зависимости от положения атомов водорода и их окружающей среды. Например, водородная связь между молекулами воды значительно усиливает ван-дер-Ваальсовы силы и повышает кипящую точку воды.
Водородная связь также может влиять на ионные связи. Ионные связи возникают между атомами с различными электроотрицательностями, что приводит к образованию ионных соединений. Водородные связи могут усиливать или ослаблять ионные связи в зависимости от их расположения относительно атомов водорода. Например, водородные связи между атомами водорода и атомами кислорода в молекуле аммиака могут усилить ионные связи в этом соединении.
Водородная связь также может взаимодействовать с другими силами, такими как дипольные взаимодействия. Дипольные взаимодействия возникают между молекулами с положительными и отрицательными концами. Водородные связи могут усилить или ослабить дипольные взаимодействия в зависимости от их геометрического расположения. Например, в молекуле этилового спирта водородные связи усиливают дипольные взаимодействия и повышают кипящую точку этого соединения.
Таким образом, водородные связи взаимодействуют с различными силами и влияют на химические свойства и структуру вещества. Понимание этих взаимодействий помогает в изучении и определении молекулярных свойств вещества и его реакций.
Влияние водородной связи на свойства молекул и соединений
Водородная связь формируется между атомами водорода и электроотрицательными атомами, такими как кислород, азот, фтор и другие. Она возникает благодаря разности электроотрицательности между этими атомами и позволяет им притягиваться друг к другу.
Водородная связь имеет ряд характеристик, которые существенно влияют на свойства молекул и соединений:
- Силу водородной связи можно определить через длину водородной связи (расстояние между двумя электроотрицательными атомами) и энергию водородной связи (энергия, необходимая для разрыва связи). Более короткая и более энергичная водородная связь обычно означает более сильное взаимодействие между молекулами.
- Водородная связь способна формировать цепочки и кольца, что позволяет молекулам образовывать комплексы и структуры более сложной организации.
- Водородная связь может оказывать влияние на физические свойства веществ, такие как температура плавления и кипения, теплоемкость и вязкость.
- Водородная связь может изменять химическую активность молекулы, влиять на ее реакционную способность и скорость химических реакций.
- Водородная связь может влиять на свойства растворов, например, на их вязкость, положение ионизации и способность растворяться в других растворителях.
В целом, водородная связь обладает большим потенциалом влиять на различные свойства молекул и соединений. Это делает ее одной из ключевых понятий в химической науке и открывает новые возможности для исследования и применения в различных областях.
Роль водородной связи в межмолекулярных взаимодействиях
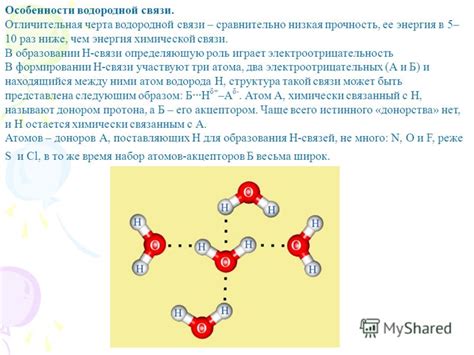
Водородная связь осуществляется между атомами водорода и атомами электроотрицательных элементов, таких как кислород, азот и фтор. Она возникает из-за разности зарядов в молекуле, приводящей к образованию положительного и отрицательного полюсов. В результате этого взаимодействия, атом водорода становится слабо положительным, притягивая электроотрицательный атом к себе.
Водородная связь имеет ряд важных физических и химических последствий. Она может сильно влиять на свойства соединений, таких как кипение, плотность, вязкость и теплоту парообразования. Водородные связи также могут быть ответственными за формирование особых структурных узлов, таких как спиральная структура двухспиральной ДНК или бета-полотнище белка.
Кроме того, водородная связь может играть важную роль в биологических системах, таких как белки, аминокислоты и нуклеиновые кислоты. Она может служить механизмом распознавания и связывания различных молекул, что позволяет осуществлять жизненно важные процессы, такие как репликация ДНК и синтез белка.
Роль водородной связи в химических реакциях
Водородная связь значительно влияет на химические реакции, так как она может изменять свойства и структуру молекул. Водородная связь может быть сильной или слабой, в зависимости от энергии связи. Сильная водородная связь может быть ключевым фактором для стабилизации молекулы и обеспечения её устойчивости.
Водородная связь может повлиять на химическую реакцию, изменяя скорость и направление протекания реакции. Она может действовать как катализатор, ускоряющий реакцию, или как ингибитор, замедляющий реакцию. Водородная связь также может влиять на химическую активность молекулы, изменяя её реакционную способность.
Водородная связь также может способствовать образованию комплексов и связей между молекулами. Она может образовывать стабильные структуры, такие как водородные мосты, влияющие на физические и химические свойства вещества. Водородные мосты могут определять физические свойства вещества, такие как кипение, плавление, плотность и растворимость.
В целом, водородная связь играет важную роль в химических реакциях, влияя на структуру и свойства молекул, а также на их химическую активность. Понимание роли водородной связи помогает улучшить наши знания о химических взаимодействиях и развивать новые методы синтеза и применения химических соединений.
Способы модификации водородной связи
Существует несколько способов модификации водородной связи:
- Введение заместителей: путем замены одного или нескольких атомов в молекуле на атомы сильнодонорного или сильноакцепторного характера, можно изменить силу или направление водородной связи.
- Модификация окружающей среды: изменение pH, концентрации растворителя или температуры может влиять на образование или разрушение водородной связи.
- Использование катионов или анионов: добавление катионов, таких как наион или калий, или анионов, таких как хлор или бром, может способствовать изменению водородной связи.
- Создание комплексов: образование комплексов с помощью других молекул или ионов может изменить силу и направление водородной связи.
Выбор конкретного способа модификации водородной связи зависит от целей и требуемых изменений. Эти способы могут быть применены в химической и биологической науке, фармацевтической и промышленной отраслях для улучшения синтеза молекул, разработки новых материалов и расширения возможностей химических реакций.
Примеры и приложение водородной связи
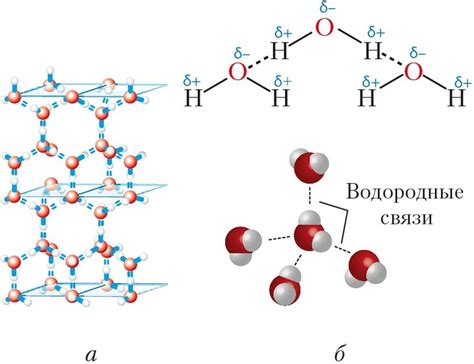
Одним из наиболее известных примеров водородной связи является связь между атомами водорода и кислорода в молекуле воды. Водородные связи отвечают за высокую коагулятивность воды и ее способность образовывать специфическую трехмерную структуру. Благодаря этим свойствам вода обеспечивает жизненно важные процессы в живых организмах и является средой для большинства биохимических реакций.
Водородная связь также играет ключевую роль при формировании вторичной структуры белков, такой как α-спираль и β-плисся, а также при связывании между комплементарными азотистыми основаниями в двухцепочечной структуре ДНК.
Более того, водородная связь проявляется во многих других химических процессах и структурах, включая формирование кристаллической решетки, образование комплексов и ионных связей, а также стабилизацию биомолекулярных комплексов, таких как ферменты и антитела.
Таким образом, водородная связь имеет огромное значение не только в химии, но и в биологии и материаловедении. Она обусловливает множество свойств веществ и как их поведение, так и структурные особенности.








