Изомерия - это явление, при котором различные соединения могут иметь одинаковую молекулярную формулу, но разную структуру и свойства. Изомеры могут образовываться как в органических, так и в неорганических соединениях, и это феномен широко изучается и применяется в химической науке.
Виды изомерии могут быть различными и зависят от структуры и связей атомов. Существуют структурная и пространственная изомерия, а также оптическая и радикальная изомерия.
Структурная изомерия возникает, когда соединения имеют одинаковые атомы, но разные порядки связей и расположение атомов в пространстве. Примерами такой изомерии могут быть изомеры алканов или алкенов, которые имеют разные расположения двойных связей.
Виды изомерии:
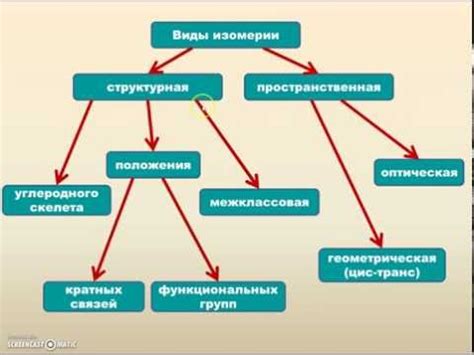
1. Структурная изомерия
Структурная изомерия является наиболее распространенным видом изомерии. Он возникает, когда молекулы имеют одинаковую химическую формулу, но различную структуру. Типичные примеры структурной изомерии включают цепные изомеры (различные упорядочение атомов внутри молекулы), изомеры групп (разные расположение функциональных групп) и геометрические изомеры (различная конфигурация групп в пространстве).
2. Изомерия функциональных групп
Этот вид изомерия возникает, когда молекулы содержат разные функциональные группы. Функциональные группы - это атомы или группы атомов, связанные между собой и отвечающие за основные свойства соединений. Примерами изомерии функциональных групп являются альдегиды и кетоны, которые имеют общую формулу CnH2nO, но разные группы функциональных групп.
3. Изомерия метамерии
Метамерия - это вид изомерии, при котором молекулы содержат одинаковое число атомов, одинаковые функциональные группы, но различную последовательность атомов внутри молекулы. Типичным примером метамерии являются изомеры углеводородов с одинаковым числом атомов, но разным расположением атомов углерода.
4. Изомерия таутомерии
Таутомерия - это частный случай структурной изомерии, при котором молекулы могут существовать в двух или более таутомерных формах. Таутомерия возникает, когда происходит переориентация атомов внутри молекулы, что приводит к изменению положения двойных связей или групп атомов. Примером таутомерии является переход ацетатной формы к метилформиатной форме карбоксилатного иона, образующего белковые структуры.
Значение и примеры
Структурная (конституционная) изомерия – это тип изомерии, при котором молекулы различаются по порядку взаимодействия атомов. Например, этиловый спирт (С2H6O) и метиловый эфир (C2H6O) являются структурными изомерами, поскольку они имеют одинаковую суммарную формулу, но различаются по порядку связей атомов.
Геометрическая изомерия – это тип изомерии, при котором молекулы различаются по пространственной ориентации атомов. Например, глюкоза (C6H12O6) и фруктоза (C6H12O6) являются геометрическими изомерами, так как их атомы имеют различное расположение в пространстве.
Оптическая изомерия – это тип изомерии, связанный с изменением плоскости поляризации света. Оптические изомеры различаются по способности поворачивать плоскость поляризации света в определенную сторону. Например, левая и правая спиральные формы аминокислот являются оптическими изомерами.
Структурная изомерия:
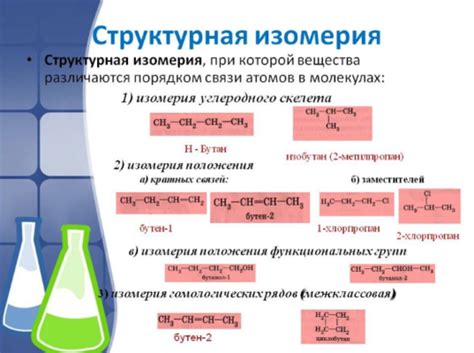
Примеры структурной изомерии:
- Циклогексан и гексан - оба имеют молекулярную формулу C6H12, но циклогексан является кольцевым углеводородом, а гексан - цепным.
- Этанол и этер - оба имеют молекулярную формулу C2H6O, но этанол является одномерным спиртом, в то время как этер является двумерным эфиром.
- Изомеры альдегидов и кетонов - оба класса соединений имеют общую формулу R-CO-R' (где R и R' могут быть различными остатками), но отличаются в положении карбоксильной группы в молекуле.
Примеры и объяснение
Ниже представлены некоторые примеры изомерии:
- Структурная изомерия: Вещества, у которых разное расположение атомов. Например, этиловый спирт (CH3CH2OH) и метилэфир (CH3OCH3) являются структурными изомерами. У этилового спирта атомы кислорода и углерода связаны прямыми связями, а у метилэфира через атом кислорода протекает непрямая связь.
- Изомерия функциональных групп: Вещества, у которых разное расположение функциональных групп. Например, метанол (CH3OH) и этилметилэфир (CH3OCH2CH3) являются изомерами функциональных групп. У метанола функциональная группа - OH, а у этилметилэфира - OCH3.
- Конформационная изомерия: Вещества, у которых разное пространственное расположение атомов при вращении связей. Например, гексан (CH3CH2CH2CH2CH2CH3) может существовать в разных конформациях, таких как прямая цепь или смещенная цепь.
- Оптическая изомерия: Вещества, которые обладают свойством поворачивать плоскость поляризованного света. Например, L-альдоза и D-альдоза являются оптическими изомерами. У них одинаковая молекулярная формула, но разное пространственное строение.
Это лишь некоторые примеры из обширного множества видов изомерии. Изучение изомерии позволяет лучше понять свойства химических соединений и их взаимодействие с окружающей средой.
Геометрическая изомерия:
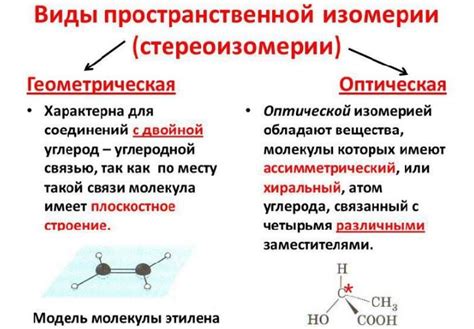
Примеры геометрической изомерии в органической химии:
- Транс-изомеры и цис-изомеры двух вещественных веществ;
- Замещенные и незамещенные изомеры;
- Алициклические изомеры и ациклические изомеры;
- Зеркальные изомеры.
Примеры геометрической изомерии в неорганической химии:
- Квадратно-плоский и октаэдрический комплексы металлов;
- Различные структуры полимеров;
- Изомеры тетраэдрической формы;
- Изомеры кубической формы.
Значение и примеры
Изомерия широко распространена в органической химии и является одной из основных причин разнообразия химических соединений. Существует несколько различных видов изомерии:
1. Структурная изомерия
Структурная изомерия возникает, когда изомеры различаются в строении связей между атомами или в расположении атомов в пространстве. Примером структурной изомерии является изомерия цепи, где у молекулы изменяется последовательность атомов. Например, изомеры пентана - нормальный пентан и изопентан:
2. Геометрическая изомерия
Геометрическая изомерия возникает, когда изомеры различаются в пространственном расположении функциональных групп или двойных связей. Примером геометрической изомерии является изомерия четыреххлористого бутена, где у молекулы изменяется расположение хлоров вокруг двойной связи:
3. Оптическая изомерия
Оптическая изомерия возникает, когда изомеры обладают оптической активностью и взаимодействуют с поляризованным светом. Оптическими изомерами являются декстро- и левовращающие аминокислоты. Они имеют одинаковый атомный состав и строение, но отличаются в способности поворачивать плоскость поляризованного света:
Изомерия играет важную роль в химии и имеет множество практических применений. Понимание изомерии позволяет более точно объяснять химические свойства и поведение соединений, а также разрабатывать новые лекарственные препараты, катализаторы и материалы.
Оптическая изомерия:

Существуют два типа оптической изомерии:
- Д-изомеры - представлены веществами, способными поворачивать плоскость поляризованного света вправо.
- Л-изомеры - представлены веществами, способными поворачивать плоскость поляризованного света влево.
Оптическая изомерия является важным понятием в химии, так как оптические изомеры имеют различные физические и химические свойства. Например, они могут иметь различное вещественное и поверхностное активности, реакционную способность и биологическую активность.
Примерами веществ, обладающих оптической изомерией, являются аминокислоты, сахара, фармацевтические препараты и другие органические соединения.











