Диссоциация вещества — это процесс разделения молекул на ионы или атомы при растворении в воде или другом растворителе. Когда вещество диссоциирует полностью, оно разлагается на ионы воды без образования молекул оригинального вещества.
Полная диссоциация является типичной для некоторых веществ, таких как натрия хлорид (NaCl), серной кислоты (H2SO4) и калия гидроксида (KOH). Натрий хлорид полностью диссоциирует, разлагаясь на натриевые и хлоридные ионы (Na+ и Cl-). Аналогично, при растворении серной кислоты ее молекулы расщепляются на два иона водорода (H+) и один ион серы (SO4^2-). Калий гидроксид диссоциирует полностью на калиевые и гидроксильные ионы (K+ и OH-).
Процесс полной диссоциации играет важную роль в химии и имеет практическое применение. Знание о том, какие вещества диссоциируют полностью, помогает ученым понимать и описывать реакции, протекающие в растворах, а также разрабатывать новые материалы и технологии.
Понимание процесса полной диссоциации невероятно полезно для широкого спектра отраслей науки и промышленности. Например, в медицине знание о полной диссоциации веществ помогает в разработке лекарств и изучении их влияния на организм. В химической промышленности использование веществ, диссоциирующих полностью, позволяет получать более чистые и стабильные продукты.
Понятие полной диссоциации в химии: что это такое?

Понятие полной диссоциации в химии относится к реакциям, в которых вещество разделяется на полные ионы или молекулы при контакте с растворителем. В результате полной диссоциации все исходные молекулы или ионы вещества расщепляются на все составляющие и полностью растворяются в растворителе. Это значит, что все вещество переходит в растворенное состояние без остатка.
Для примера можно рассмотреть полную диссоциацию соли, например, хлорида натрия (NaCl), в водном растворе. При контакте с водой каждая молекула NaCl расщепляется на два иона: натриевый катион (Na+) и хлоридный анион (Cl-). Оба иона полностью растворяются в воде и не остаются в виде нерастворимых остатков.
Концентрация реагентов в растворе и температурные условия могут влиять на степень диссоциации реакции. В случае полной диссоциации степень диссоциации будет равна 100%, что означает, что все ионные или молекулярные вещества полностью растворились.
Определение полной диссоциации
При полной диссоциации молекулы вещества разделяются на отдельные ионы, каждый из которых обладает зарядом, положительным или отрицательным. Например, соль натрия (NaCl) полностью диссоциирует в растворе, образуя натриевые и хлоридные ионы (Na+ и Cl-).
Полная диссоциация в растворе является идеализированным случаем, который не всегда реализуется на практике. Факторы, такие как концентрация раствора, температура и другие условия, могут влиять на степень диссоциации вещества.
Понимание полной диссоциации является важным для изучения химических реакций и свойств различных веществ. Знание того, какие вещества диссоциируют полностью, позволяет нам предсказывать их поведение в растворах и использовать эти знания в практических целях.
Примеры полной диссоциации
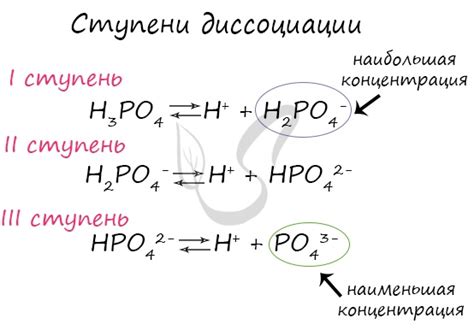
Некоторые примеры веществ, которые полностью диссоциируют в водном растворе:
- Соль натрия (NaCl): Когда NaCl растворяется в воде, он полностью диссоциирует на натрий (Na+) и хлоридные (Cl-) ионы. Уравнение реакции диссоциации выглядит так: NaCl -> Na+ + Cl-
- Кислота соляная (HCl): При взаимодействии с водой, соляная кислота диссоциирует полностью на водородные (H+) и хлоридные (Cl-) ионы. Уравнение реакции диссоциации: HCl -> H+ + Cl-
- Щелочь натрия (NaOH): При растворении в воде, щелочь натрия полностью диссоциирует на натриевые (Na+) и гидроксидные (OH-) ионы. Уравнение реакции диссоциации: NaOH -> Na+ + OH-
Это только некоторые примеры веществ, которые полностью диссоциируют в растворе. Полная диссоциация имеет важное значение в химических реакциях и в общей химии, помогая понять взаимодействие веществ в растворе.
Как считать, что вещество диссоциирует полностью?
Чтобы определить, что вещество диссоциирует полностью, можно обратить внимание на несколько факторов:
| 1. | Степень диссоциации. Если вещество полностью диссоциирует, то все его молекулы распадаются на ионы или радикалы в растворе. Это значит, что полная ионизация происходит без образования остаточных молекул или нерастворимых соединений. |
| 2. | Закон сохранения массы. Когда вещество диссоциирует полностью, суммарная масса продуктов диссоциации будет равна массе исходного вещества. Это позволяет определить, что диссоциация происходит без потери массы. |
| 3. | Термодинамические параметры. Для полной диссоциации вещества должны быть соблюдены определенные температурные и давностные условия. Если вещество диссоциирует полностью, то его термодинамические параметры, такие как энтропия и энтальпия, будут соответствовать предполагаемой степени диссоциации. |
Примером вещества, которое диссоциирует полностью, является хлорид натрия (NaCl). При растворении хлорида натрия в воде, все его молекулы распадаются на ионы натрия (Na+) и хлора (Cl-), что соответствует полной диссоциации. В результате такого процесса не остается остаточных молекул или нерастворимых соединений, и суммарная масса продуктов диссоциации равна массе исходного вещества.
Критерии полной диссоциации
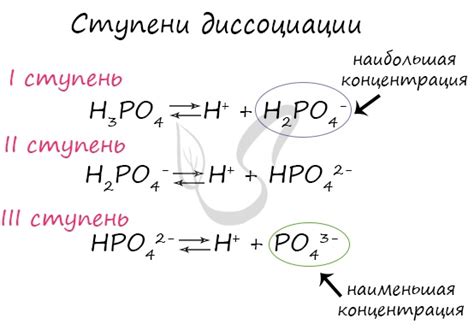
Для того чтобы вещество считалось диссоциировавшимся полностью, должны выполняться следующие критерии:
| Критерий | Объяснение |
|---|---|
| Вещество должно быть электролитом | Только электролиты могут диссоциироваться на ионы в растворах. |
| Вещество должно полностью диссоциировать | Это означает, что все молекулы вещества разделяются на ионы в растворе. |
| Ионы должны быть полностью растворены без образования осадка | Осадок может образовываться, когда с молекулами ионов вступают взаимодействие, не диссоциирующие молекулы или нерастворимые ионы. |
| Молярные коэффициенты реакции должны быть равными | Концентрации ионов, образовавшихся от диссоциации, должны быть одинаковыми и соответствовать коэффициентам реакции. |
Несколько примеров веществ, которые диссоциируют полностью в растворе:
- Кислота: HCl → H+ + Cl-
- Щелочи: NaOH → Na+ + OH-
- Солями: NaCl → Na+ + Cl-
Зачем нужна полная диссоциация?
Полная диссоциация особенно важна при проведении химических реакций и расчетах. Если вещество диссоциирует полностью, то мы можем точно знать количество ионов или молекул, которые участвуют в реакции или находятся в растворе. Это позволяет нам проводить более точные расчеты и прогнозировать результаты реакций с большей уверенностью.
Например, при проведении реакции между соляной кислотой (HCl) и гидроксидом натрия (NaOH), образуется хлорид натрия (NaCl) и вода (H₂O). Если мы знаем, что оба реагента диссоциируют полностью, то мы можем точно знать, что каждый молекула соляной кислоты даст один ион водорода (H⁺) и один ион хлора (Cl⁻), а каждая молекула гидроксида натрия даст один ион натрия (Na⁺) и один ион гидроксида (OH⁻). Таким образом, мы можем легко определить стехиометрическое соотношение между реагентами и продуктами, а также рассчитать их количество.
| Вещество | Молекула | Ионы |
|---|---|---|
| Соляная кислота (HCl) | 1 | 1 H⁺, 1 Cl⁻ |
| Гидроксид натрия (NaOH) | 1 | 1 Na⁺, 1 OH⁻ |
| Хлорид натрия (NaCl) | 1 | 1 Na⁺, 1 Cl⁻ |
| Вода (H₂O) | 1 | 1 H⁺, 1 OH⁻ |
Таким образом, полная диссоциация веществ позволяет нам лучше понимать химические реакции, проводить точные расчеты и делать более точные прогнозы.
Полная диссоциация в химических реакциях
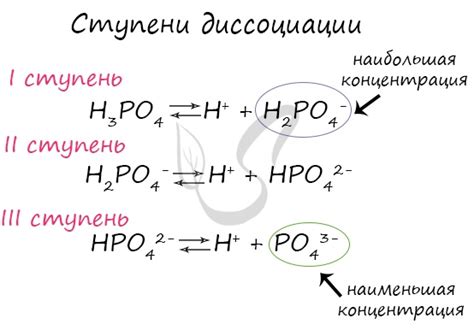
Полная диссоциация в химических реакциях означает, что вещество разделяется на ионы или молекулы с полной сохранностью своей массы. В результате полной диссоциации, все молекулы вещества распадаются на ионы или молекулы, которые остаются в растворе или реакционной смеси.
Примером полной диссоциации может служить растворение соли в воде. Например, при растворении хлорида натрия (NaCl) в воде, молекулы NaCl распадаются на положительные ионы натрия (Na+) и отрицательные ионы хлорида (Cl-). В данном случае полная диссоциация происходит, поскольку все молекулы NaCl разделяются на ионы без потери массы вещества.
Таблица ниже приводит примеры веществ, которые диссоциируют полностью:
| Вещество | Распад | Ионы/молекулы |
|---|---|---|
| Хлорид натрия (NaCl) | NaCl → Na+ + Cl- | Na+, Cl- |
| Кислота соляная (HCl) | HCl → H+ + Cl- | H+, Cl- |
| Сера оксид (SO2) | SO2 → SO2 | SO2 |
Полная диссоциация играет важную роль в химических реакциях, поскольку позволяет рассчитать количество продуктов реакции и определить его соотношение к начальным реагентам. Она также влияет на скорость реакции и образование новых соединений. Понимание полной диссоциации помогает химикам предсказывать результаты химических реакций и разрабатывать новые соединения и материалы.
Влияние факторов на полную диссоциацию
При диссоциации вещества полностью, все его молекулы разделяются на ионы в процессе реакции. Однако, существует ряд факторов, которые могут повлиять на степень диссоциации и определить, будет ли она полной или неполной.
1. Реакционная способность вещества: Вещества с высокой реакционной способностью, такие как сильные электролиты, обладают большей склонностью к полной диссоциации. Это происходит из-за высокой энергии, которая способствует разрыву молекулярных связей.
2. Концентрация раствора: Повышение концентрации раствора может увеличить степень диссоциации. При более высокой концентрации, количество частиц в растворе становится больше, что создает больше возможностей для взаимодействия и диссоциации молекул вещества.
3. Температура: Повышение температуры также способствует полной диссоциации вещества. Увеличение температуры увеличивает энергию молекул, что способствует разрыву связей и образованию ионов.
4. Размер ионообразующей молекулы: Маленькие молекулы диссоциируют лучше, так как их связи проще разорвать. Большие молекулы могут иметь более прочные связи, что затрудняет их диссоциацию.
5. Реакционная среда: Некоторые реакционные среды, такие как кислоты или щелочи, могут способствовать полной диссоциации вещества благодаря их реакционной активности и способности образовывать ионы.
Все эти факторы влияют на степень диссоциации вещества и могут определить, насколько полной она будет. Понимание этих факторов позволяет улучшить понимание работы реакций диссоциации и их результата.
Применение полной диссоциации в практических целях

Полная диссоциация вещества играет важную роль во многих практических областях. Это позволяет ученным и исследователям проводить точные расчеты и измерения, а также создавать новые продукты и технологии.
Одним из примеров применения полной диссоциации является использование электролитов в различных электрохимических процессах. Электролиты, такие как соли или кислоты, диссоциируют полностью в растворе и создают ионы, которые участвуют в химических реакциях. Это позволяет электролитам быть эффективными в проведении электролиза, покрытия металлов и других процессах.
Еще одним примером является использование полной диссоциации при производстве лекарственных препаратов. Некоторые вещества теряют свою активность при заполнении капсул или создании таблеток. В таких случаях производители должны использовать либо соль с полной диссоциацией, чтобы обеспечить достаточную концентрацию активного вещества в препарате.
Также полная диссоциация используется в аналитической химии для точного определения содержания химических элементов в образцах. Методы, такие как титрование, основаны на полной диссоциации реагента, который реагирует с анализируемым веществом. Это позволяет ученым проводить точные расчеты и определять концентрацию веществ с высокой степенью точности.
В общем, полная диссоциация вещества является неотъемлемым элементом многих химических процессов и находит широкое применение в различных отраслях науки и промышленности.
Важность полной диссоциации для учебного процесса
Полная диссоциация вещества играет важную роль в химическом образовании и учебном процессе. Когда вещество диссоциирует полностью, оно распадается на ионы или молекулы, что позволяет лучше понять его химические свойства и взаимодействия с другими веществами.
Для студентов, изучающих химию, полная диссоциация является основой для понимания многих химических реакций и ситуаций. Например, при изучении кислот и щелочей, знание о полной диссоциации позволяет определить их концентрацию и нейтрализацию. Полная диссоциация также важна при изучении электролитов и ионных соединений.
Понимание полной диссоциации позволяет студентам применять ее в решении химических задач и проведении экспериментов. Например, если студенту известна полная диссоциация моли серной кислоты (H2SO4), он может рассчитать концентрацию ионов в растворе и предсказать, как будет протекать реакция с другим веществом.
| Примеры веществ, диссоциирующих полностью: | Химическая формула |
|---|---|
| Соляная кислота | HCl |
| Серная кислота | H2SO4 |
| Натрия гидроксид | NaOH |
| Калия гидроксид | KOH |
Важность полной диссоциации в учебном процессе заключается в том, что она помогает студентам углубить свои знания и понимание химических процессов. Полная диссоциация также является основой для дальнейшего изучения химии и применения ее в практических задачах.








