Электроотрицательность это важная характеристика химического элемента, определяющая способность атома притягивать электроны в химической связи. Чем выше электроотрицательность, тем сильнее атом притягивает электроны, что может приводить к изменению полярности молекулы и образованию химических связей. Уменьшение электроотрицательности означает снижение способности атома притягивать электроны, что может иметь важные последствия для химической реактивности и свойств вещества.
Одним из основных понятий, связанных с уменьшением электроотрицательности, является понятие электронавтомии. Электронавтомия - это мера разности электроотрицательности в химической связи между двумя атомами. Чем меньше разность электроотрицательности, тем меньше электронавтомия и тем более равномерно распределены электроны между атомами. Это может привести к формированию сильных и стабильных связей и изменению свойств вещества.
Примером элементов с уменьшенной электроотрицательностью являются металлы, такие как натрий, калий и медь. У них низкая способность притягивать электроны и большая склонность к отдаче электронов другим атомам. Это объясняет их высокую реактивность и способность к образованию ионов в процессе химических реакций.
Уменьшение электроотрицательности также может происходить при изменении электронной конфигурации атома или при наличии специфических атомных или молекулярных групп. Это может приводить к изменению химических свойств и структуры вещества. Понимание уменьшения электроотрицательности играет важную роль в химии и может помочь в понимании реакций и свойств различных веществ.
Уменьшение электроотрицательности: основные понятия и примеры

Уменьшение электроотрицательности означает снижение способности атомов привлекать электроны. Это может быть связано с увеличением размера атомов, снижением их зарядов или изменением электронной структуры.
Одним из примеров уменьшения электроотрицательности является движение по периоду в периодической системе элементов. Например, атомы металлов, таких как натрий (Na) и калий (K), имеют меньшую электроотрицательность по сравнению с атомами неметаллов, таких как кислород (O) или фтор (F). Это связано с тем, что атомы металлов имеют большие размеры и меньшие заряды, что уменьшает их способность привлекать электроны.
Еще одним примером уменьшения электроотрицательности является допирование в полупроводниках. Путем добавления фремированных примесей, таких как бор (B) или галлий (Ga), в полупроводниковые материалы, такие как кремний (Si), можно снизить электроотрицательность материала. Это делает полупроводники более подходящими для проводниковых приложений, таких как создание транзисторов или интегральных схем.
Электроотрицательность: определение и значение
Электроотрицательность измеряется в единицах паули и принимает значения от 0 до 4. Чем выше значение электроотрицательности элемента, тем сильнее он притягивает электроны в связи.
Значение электроотрицательности элемента влияет на свойства химических соединений. Например, при образовании ионно-кавалентных связей элементы с высокой электроотрицательностью обычно притягивают электроны к себе, образуя отрицательно заряженные ионы. Элементы с низкой электроотрицательностью, напротив, отдают электроны, образуя положительно заряженные ионы.
Значение электроотрицательности также влияет на полярность химических связей. В молекуле с полярной связью электроотрицательный элемент образует положительный полюс, а менее электроотрицательный элемент – отрицательный полюс.
Например, в молекуле воды (H2O) кислород, обладающий высокой электроотрицательностью, создает отрицательный полюс, а водород – положительный полюс. Это делает молекулу воды полярной и определяет ее химические и физические свойства, такие как способность образовывать водородные связи и высокую теплоту парообразования.
Значение уменьшения электроотрицательности
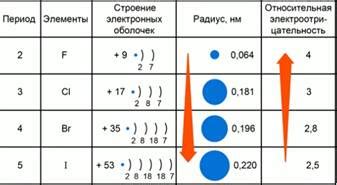
Понятие уменьшения электроотрицательности важно для понимания химических связей и реакций. Атомы с низкой электроотрицательностью имеют большую склонность образовывать катионы во время химических реакций, атомы с высокой электроотрицательностью - образовывать анионы. Это свойство влияет на образование и характеристики химических соединений, а также на их реактивность и физические свойства.
Примерами атомов с низкой электроотрицательностью являются металлы, такие как натрий (Na) и калий (K), атомы с высокой электроотрицательностью - неметаллы, такие как кислород (O) и фтор (F). Например, в химической реакции между натрием и хлором образуется ионное соединение - хлорид натрия (NaCl), где натрий отдает электрон хлору из-за разницы в их электроотрицательности.
Таким образом, уменьшение электроотрицательности является важным понятием в химии, которое помогает объяснить формирование и свойства химических соединений на основе взаимодействия атомов и их способности притягивать электроны.
Периодическая система элементов
В периодической системе элементов каждый элемент обозначается химическим символом, который состоит из одной или двух букв (например, H - водород, He - гелий). Каждый элемент имеет свой уникальный атомный номер, который указывает на количество протонов в ядре атома.
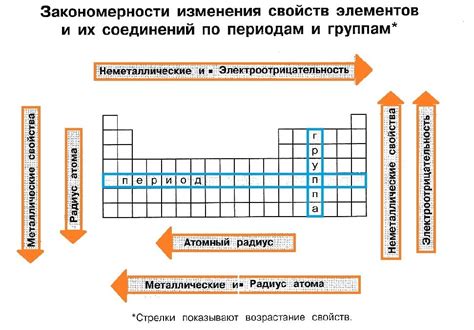
Периодическая система элементов также позволяет классифицировать элементы по их свойствам, таким как электроотрицательность. Электроотрицательность характеризует способность атома притягивать электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны.
Периодическая система элементов также позволяет наблюдать закономерности в свойствах элементов. Например, в каждой группе элементов количество электронов в внешней оболочке одинаково, что влияет на их химические свойства. Это позволяет делать прогнозы о химической активности элементов.
Важные элементы с уменьшенной электроотрицательностью
Некоторые элементы характеризуются уменьшенной электроотрицательностью, что означает их меньшую способность притягивать электроны в молекулярных связях. Эти элементы обладают свойствами, которые могут быть важными для различных химических процессов и применений.
Самым известным примером элемента с уменьшенной электроотрицательностью является гелий (He), расположенный во втором периоде периодической таблицы. Гелий - инертный газ, который не образует химические связи с другими элементами. Его низкая электроотрицательность делает его стабильным и безопасным, что делает его полезным в различных приложениях, таких как заполнение шариков и использование в аэронавтике.
Другой пример элемента с уменьшенной электроотрицательностью - это углерод (C), находящийся в четвертом периоде п таблицы. Несмотря на то, что углерод является неметаллом, он обладает умеренной электроотрицательностью, что позволяет ему создавать стабильные связи со многими другими элементами. Углерод присутствует во многих органических соединениях и является основным строительным блоком жизни. Это также делает его важным для различных индустриальных процессов, включая производство пластмасс и топлива.
Подобно углероду, кремний (Si) - элемент с уменьшенной электроотрицательностью. Он также находится в четвертом периоде периодической таблицы и образует множество стабильных соединений. Кремний играет важную роль в электронике и полупроводниковой промышленности, где его способность образовывать связи с другими элементами используется для создания полупроводниковых материалов и интегральных схем.
Эти примеры демонстрируют, что элементы с уменьшенной электроотрицательностью имеют уникальные свойства и играют значимую роль в различных областях науки и промышленности.
Основные свойства элементов с уменьшенной электроотрицательностью
Элементы с уменьшенной электроотрицательностью обладают определенными свойствами, которые отличают их от элементов с более высокой электроотрицательностью. Ниже представлена таблица с основными характеристиками таких элементов:
| Свойство | Описание |
|---|---|
| Малая способность привлекать электроны | Элементы с уменьшенной электроотрицательностью имеют меньшую способность привлекать электроны к себе. Это означает, что они обладают большей склонностью к отдаче электронов другим элементам. |
| Слабые кислотные свойства | Элементы с уменьшенной электроотрицательностью обычно проявляют слабые кислотные свойства, то есть они могут слабо отдавать протоны другим веществам. |
| Хорошие основания | Элементы с низкой электроотрицательностью могут быть хорошими основаниями, то есть они способны принимать протоны от других веществ, проявляя щелочные свойства. |
| Металлический характер | Элементы с уменьшенной электроотрицательностью обычно имеют большую склонность проявлять металлические свойства. Они обладают высокой электропроводностью и могут образовывать ионы положительного заряда. |
Элементы с уменьшенной электроотрицательностью имеют свои особенности и играют важную роль во многих химических реакциях и соединениях.
Примеры соединений с элементами уменьшенной электроотрицательностью

Уменьшение электроотрицательности элемента означает, что он обладает меньшей способностью притягивать электроны во время химических реакций. Здесь приведены несколько примеров соединений с элементами, у которых электроотрицательность сравнительно низкая:
1. Ксенон (Xe): Ксенон является инертным газом с очень низкой электроотрицательностью. Он образует различные соединения с другими элементами, например, с галогенами (XeF2, XeF4, XeF6) и кислородом (XeO3, XeO4), но его способность к химическим реакциям ограничена.
2. Барий (Ba): Барий является щелочноземельным металлом с относительно низкой электроотрицательностью. Он образует различные соли, например, барий сульфат (BaSO4) и барий хлорид (BaCl2).
3. Серебро (Ag): Серебро является переходным металлом с низкой электроотрицательностью. Оно образует различные соединения, такие как серебро оксид (Ag2O) и серебро нитрат (AgNO3).
4. Гелий (He): Гелий является инертным газом с очень низкой электроотрицательностью. Он образует различные соединения в экстремальных условиях, например, гелиевые кластеры (He2, He3) и гелиевые ионы (He+).
Уменьшение электроотрицательности в химических реакциях
Во многих реакциях, атомы с высокой электроотрицательностью могут притягивать электроны с атомов с низкой электроотрицательностью, что приводит к образованию полярных связей. Однако, электроотрицательность может уменьшаться в результате химической реакции.
Примером такого уменьшения электроотрицательности является реакция между атомами натрия (Na) и хлора (Cl). Атом натрия имеет низкую электроотрицательность, равную 0,9, тогда как атом хлора обладает высокой электроотрицательностью, равной 3,0.
При реакции между натрием и хлором, происходит перенос электронов от атома натрия к атому хлора. Это приводит к образованию ионов натрия (Na+) и хлорида (Cl-). Полученный хлорид имеет увеличенную электроотрицательность по сравнению с атомом хлора, так как в нем наблюдается отрицательный заряд.
Таким образом, в результате химической реакции электроотрицательность атома хлора уменьшается из-за образования иона, обладающего отрицательным зарядом, в то время как электроотрицательность атома натрия остается неизменной.
Уменьшение электроотрицательности в химических реакциях имеет важные последствия для образования и структуры различных веществ, а также для понимания химических связей и взаимодействий между атомами.
Влияние уменьшения электроотрицательности на связи и вещества
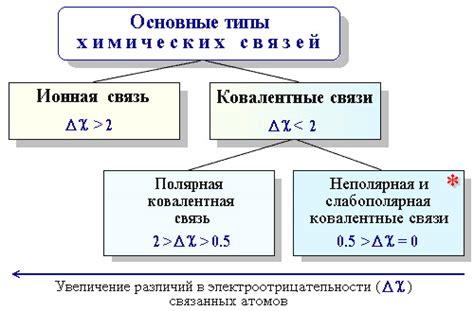
Если электроотрицательность атомов вещества уменьшается, то связь становится менее полярной и более ковалентной. В ковалентных связях электроны между атомами распределяются более равномерно и оба атома равномерно делят электроны. Такие связи часто характеризуются высокой прочностью и стабильностью. Примером вещества с ковалентной связью является молекулярный кислород (O2).
Уменьшение электроотрицательности также может привести к образованию ионных связей. В ионной связи один атом отдает электроны другому атому, образуя положительный и отрицательный ионы соответственно. Уменьшение электроотрицательности атомов способствует образованию ионных связей, так как один атом будет менее способен притягивать электроны к себе, а другой атом будет лучше электроотрицателен. Примером вещества с ионной связью является соль (NaCl).
| Связь | Пример вещества |
|---|---|
| Ковалентная связь | Молекулярный кислород (O2) |
| Ионная связь | Соль (NaCl) |








