Таблица Менделеева - это систематическое представление всех химических элементов, упорядоченных по порядку возрастания их атомных номеров. Она сыграла огромную роль в развитии химии и стала основой для понимания свойств и взаимодействия элементов. С помощью таблицы Менделеева химики могут легко найти информацию о любом элементе и его химических свойствах.
Таблица Менделеева состоит из нескольких горизонтальных строк, которые называются периодами. Каждый период представляет собой новый энергетический уровень или оболочку вокруг ядра атома. Начиная с первого периода, в таблице Менделеева расположены элементы с атомами, содержащими 1 до 118 протонов в ядре.
Периоды таблицы Менделеева имеют большое значение для понимания и классификации химических элементов. Каждый период характеризуется увеличением количества энергетических уровней и внешних электронов, что влияет на химическое поведение элементов в этом периоде. Кроме того, в каждом периоде имеются особые химические свойства элементов, которые помогают определить их электронную конфигурацию и место в таблице Менделеева.
Периоды таблицы Менделеева:

Таблица Менделеева состоит из 7 периодов, которые горизонтально расположены от верхнего к нижнему краю таблицы. Каждый период имеет свой номер, начиная с 1 и заканчивая 7.
Периоды в таблице Менделеева служат для определения энергетического уровня электронов в атомах. Каждый период соответствует энергетическому уровню электронных оболочек атома. Так, первый период соответствует оболочке K, второй период - оболочке L, третий - M и так далее.
Каждый период включает в себя разное количество элементов. Например, первый период содержит два элемента: водород и гелий. Второй период уже включает восемь элементов, начиная с лития и заканчивая неоном. Третий период содержит 8 элементов, четвертый - 18 элементов, пятый - 18 элементов, шестой - 32 элемента и седьмой - 32 элемента.
Периоды таблицы Менделеева имеют большое значение для определения химических свойств элементов. Каждый период характеризуется изменением одного и того же электронного уровня, что влияет на реакционную способность элементов и их атомную структуру. Понимание периодов помогает установить закономерности и тенденции в периодической системе элементов.
Первый период: важность элементов группы 1 и 2
Первый период таблицы Менделеева состоит из двух групп элементов: группы 1 и группы 2. Эти элементы играют важную роль в химии и имеют различные свойства и приложения.
Группа 1 элементов, также известных как щелочные металлы, включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми реактивными металлами в таблице Менделеева и обладают характерными свойствами, такими как низкая плотность, низкая температура плавления и высокая реактивность с водой и кислородом. Щелочные металлы широко используются в различных областях, включая производство батарей, стекла и радиоактивных изотопов для медицинских и научных исследований.
Группа 2 элементов, также известных как щёлочноземельные металлы, включает в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы менее реактивны, чем элементы группы 1, но все равно обладают химической активностью. Щёлочноземельные металлы широко используются в различных областях, включая производство сплавов, фармацевтику и сельское хозяйство.
Важность элементов группы 1 и 2 заключается в их участии в различных химических реакциях и влиянии на свойства других химических соединений. Они служат основой для многих химических процессов и находят применение в различных отраслях промышленности и научных исследованиях.
Второй период: рост электроотрицательности элементов
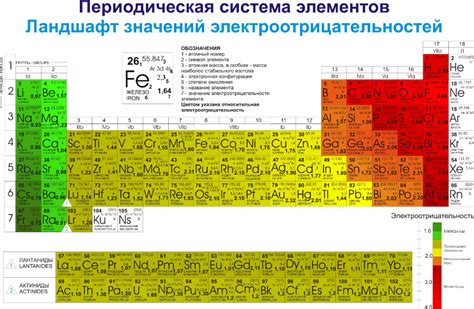
В таблице Менделеева второй период представлен второй горизонтальной строкой элементов. В этом периоде находятся элементы от лития (Li) до неона (Ne), включая 8 элементов.
Главной особенностью второго периода является резкий рост электроотрицательности элементов. Электроотрицательность – это способность атома притягивать к себе электроны в химической связи. Второй период характеризуется тем, что электроотрицательность элементов увеличивается от левого к правому краю.
Первым элементом второго периода является литий (Li) с атомным номером 3. Литий очень реактивен и обладает высокой электроотрицательностью. Он способен легко отдавать один электрон, образуя положительные ионы.
Последним элементом второго периода является неон (Ne) с атомным номером 10. Неон – инертный газ, не образующий химические связи с другими атомами. Он обладает низкой электроотрицательностью и полностью заполненной внешней электронной оболочкой.
Рост электроотрицательности элементов во втором периоде объясняется увеличением заряда ядра именно благодаря увеличению количества протонов. Увеличение заряда ядра приводит к большему притяжению электронов к ядру, что в свою очередь делает электроотрицательность элементов выше.
Рост электроотрицательности элементов второго периода играет важную роль в химических реакциях. Наличие большой электроотрицательности у элементов обуславливает их активность и способность образовывать различные химические соединения.
Третий период: появление элементов третьей группы
Элементы третьей группы имеют общую химическую характеристику - наличие трех валентных электронов. Это означает, что эти элементы могут образовывать соединения, в которых участвуют три электрона. Такие соединения обладают определенными химическими свойствами и находят применение в различных отраслях промышленности и науки.
Наиболее известным элементом третьей группы является алюминий. Он широко используется в производстве металлоконструкций, авиации, автомобилестроении, пищевой промышленности и многих других отраслях. Благодаря своей легкости и прочности, алюминий стал неотъемлемым материалом в современном мире.
Элементы третьей группы также имеют большое значение в биологии. Например, натрий и калий являются основными ионами, необходимыми для поддержания нормальной работы клеток организма. Они участвуют в передаче нервных импульсов и контроле сокращений мышц.
Третий период таблицы Менделеева - это важный этап в развитии науки, который позволяет лучше понять химические свойства и применение элементов третьей группы. Изучение этих элементов имеет широкие практические применения и способствует развитию различных отраслей науки и технологий.
Четвертый период: особенности элементов групп 4-7
Четвертый период таблицы Менделеева включает элементы группы 4 (углерод, кремний, германий, олово) до группы 7 (марганец, железо, кобальт, никель). Этот период характеризуется наличием четырех электронных слоев в атомах элементов.
В этом периоде находятся некоторые из наиболее важных и широко используемых элементов, такие как углерод, кремний, железо. Природа этих элементов важна не только из-за их широкого использования в промышленности, но и из-за свойств, которые они обладают.
В четвертом периоде элементы имеют различные электроотрицательности, что означает, что они способны образовывать различные химические связи. Например, углерод может образовывать четырехвалентные соединения, такие как метан, азот может образовывать трехвалентные соединения, такие как аммиак.
Одной из значительных особенностей этого периода является появление d-элементов в группах 3-7. Эти элементы имеют способность образовывать дополнительные внешние электронные оболочки, что делает их более сложными и интересными с точки зрения их взаимодействия с другими элементами и их ролью в химии.
Кроме того, в четвертом периоде наблюдается убывающая активность элементов по горизонтали. Это означает, что элементы крайних групп (углерод и марганец) обладают более высокой активностью, чем элементы внутренних групп. Например, углерод активен как неметалл и может образовывать множество соединений, в то время как марганец, находящийся в той же периоде, но в другой группе, активен как металл и образует меньшее число соединений.
Пятый период: появление лантаноидов и актиноидов
Лантаноиды - это серия элементов, начинающаяся с элемента лантана (La) и заканчивающаяся лутецием (Lu). Они имеют схожие электронные конфигурации и обладают подобными химическими свойствами. Лантаноиды обладают высокой реактивностью и широко применяются в различных сферах науки и техники.
Актиноиды - другая серия элементов, которая начинается с элемента актиния (Ac) и заканчивается резерфордием (Rf). Актиноиды также обладают схожими химическими свойствами и являются очень реактивными. Они широко используются в ядерной энергетике и других областях техники.
Появление лантаноидов и актиноидов в таблице Менделеева показывает, что природа элементов имеет закономерности и что они могут быть упорядочены в таблицу на основе их свойств. Этот открытие оказало огромное влияние на развитие химии и позволило лучше понять структуру и свойства элементов.
Шестой период: элементы группы 8
Шестой период таблицы Менделеева включает в себя элементы группы 8, которые также известны как группа железа или металлы платины. Эта группа включает следующие элементы:
- Железо (Fe) - элемент с атомным номером 26 и относительной атомной массой 55,845. Железо является одним из самых распространенных элементов на Земле и имеет широкое применение в различных отраслях промышленности.
- Рутений (Ru) - элемент с атомным номером 44 и относительной атомной массой 101,07. Рутений используется в качестве катализатора в различных химических процессах и также может применяться в ювелирной промышленности.
- Осмий (Os) - элемент с атомным номером 76 и относительной атомной массой 190,23. Осмий является одним из наиболее плотных элементов и используется в производстве специализированной техники.
- Хасиум (Hs) - элемент с атомным номером 108 и относительной атомной массой 277. Химические и физические свойства хасия пока недостаточно изучены из-за его крайне низкой стабильности.
- Мейтнерий (Mt) - элемент с атомным номером 109 и относительной атомной массой 278. Мейтнерий также имеет низкую стабильность и его свойства пока остаются плохо изученными.
- Дармштадтий (Ds) - элемент с атомным номером 110 и относительной атомной массой 281.
- Рентгений (Rg) - элемент с атомным номером 111 и относительной атомной массой 282.
- Коперниций (Cn) - элемент с атомным номером 112 и относительной атомной массой 285.
- Нихоний (Nh) - элемент с атомным номером 113 и относительной атомной массой 286.
- Флеровий (Fl) - элемент с атомным номером 114 и относительной атомной массой 289.
- Московий (Mc) - элемент с атомным номером 115 и относительной атомной массой 288.
- Ливерморий (Lv) - элемент с атомным номером 116 и относительной атомной массой 293.
- Теннессин (Ts) - элемент с атомным номером 117 и относительной атомной массой 294.
- Оганесон (Og) - элемент с атомным номером 118 и относительной атомной массой 294.
Элементы группы 8 обладают разнообразными свойствами и находят применение в различных областях науки и технологии. Изучение и использование этих элементов играют важную роль в современном мире.
Седьмой период: синтез элементов путем ядерных реакций
Седьмой период таблицы Менделеева начинается с элемента франций (Fr) и заканчивается элементом унунпентий (Uup). В этом периоде происходит синтез элементов путем ядерных реакций.
Ядерные реакции – это процессы, при которых происходят изменения в ядрах атомов. В результате таких реакций иногда образуются новые элементы. В седьмом периоде происходит синтез новых элементов, которых нет в природе.
Синтез элементов путем ядерных реакций может быть осуществлен в лабораториях с помощью акселераторов частиц. Для этого необходимо столкнуть частицы с высокой энергией друг с другом или с таргетом из ядерного материала. В результате таких столкновений могут образовываться новые элементы.
В седьмом периоде таблицы Менделеева уже были синтезированы несколько элементов. Это, например, элементы 110 (дармштадтий), 111 (рентгений), 112 (коперниций) и другие. Синтез таких элементов является сложным и длительным процессом, требующим современных технологий и специального оборудования.
Изучение синтеза элементов путем ядерных реакций в седьмом периоде таблицы Менделеева важно для науки и технологий. Это позволяет расширить наше понимание о строении атомов и создать новые материалы с уникальными свойствами.
Восьмой период: гипотетическая неподвижность элементов
Гипотетический унуноктий и пока не открыт, и его свойства известны только на основании расчетов и предположений. Предполагается, что унуноктий будет являться самым тяжелым элементом в таблице Менделеева и будет обладать свойствами, характерными для нобелиевого газа.
Позиция унуноктия в восьмом периоде демонстрирует интересную закономерность. Восьмой период является заключительным, и его длина может быть объяснена концепцией заполнения электронных оболочек в атомах. Если верить этой концепции, то восьмой период должен быть полностью заполнен и в нем не должно быть элементов с пустыми или неполными оболочками. Таким образом, унуноктий можно считать символическим завершением таблицы Менделеева и своего рода подтверждением ее законченной структуры.








