Периодическая система Менделеева – это систематическое представление химических элементов, которые упорядочены по возрастанию атомных номеров и разделены на периоды и группы. Группы в периодической системе Менделеева – это столбцы элементов, которые имеют сходные химические свойства и электронную конфигурацию.
Каждая группа внутри периодической системы Менделеева имеет свой номер – от 1 до 18, и они также известны как колонки. Главные группы, или A-группы, состоят из элементов с валентными электронами в s- и p-орбиталях, а переходные металлы, или B-группы, имеют валентные электроны в d- и f-орбиталях.
Группы в периодической системе Менделеева определены по номерам и буквенным обозначениям, таким как IA, IIA, VIIA, VIII, и т. д. Число перед буквенным обозначением указывает на количество валентных электронов у элементов в данной группе, кроме VIII группы, которая является инертными газами и имеет полностью заполненные электронные оболочки.
Изучение групп в периодической системе Менделеева имеет большое значение для понимания закономерностей химических свойств элементов и их взаимодействия с другими веществами. Классификация элементов по группам позволяет нам предсказывать и объяснять их химическое поведение и находить аналогии между различными элементами.
Значение и структура периодической системы
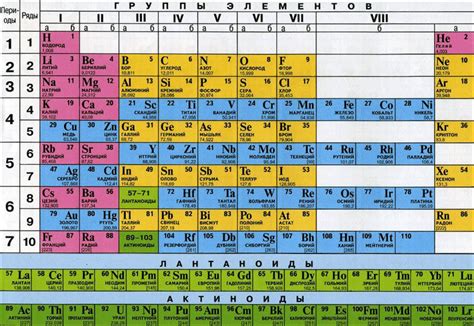
В периодической таблице элементы объединены в вертикальные столбцы, которые называются группами. Каждая группа содержит элементы с аналогичными химическими свойствами, такими как тенденция к образованию ионов, reactivity, электроотрицательность и т.д. Группы также имеют общую структуру электронной оболочки, что является основой для определения химических свойств элементов.
Наиболее известные группы в периодической системе - щелочные и щелочноземельные металлы, галогены, благородные газы и транзиционные металлы. Однако, в таблице имеется много других групп, каждая из которых имеет свои уникальные характеристики и свойства.
Структура периодической таблицы позволяет легко анализировать и предсказывать химическое поведение элементов. Благодаря этому, ученые могут классифицировать и изучать химические реакции, исследовать связи между элементами и разрабатывать новые материалы и соединения. Периодическая система Менделеева является неотъемлемой частью химии и является универсальным инструментом в научных и практических приложениях.
Роль группы в периодической системе
Каждая группа имеет свой номер, присвоенный Менделеевым, и обычно обозначается числом от 1 до 18. Группа 1, известная как группа щелочных металлов, содержит элементы с очень активной химической природой. Они реагируют с водой и воздухом, и их соединения широко используются в различных промышленных процессах.
Группа 2, или группа щелочноземельных металлов, также содержит активные элементы, но они менее реактивны, чем элементы первой группы. Щелочноземельные металлы часто используются в конструкционном материаловедении.
Группы 3-12 называются переходными металлами. Эти элементы обладают разнообразными химическими свойствами и широко применяются в различных областях, включая катализ, электротехнику и легкую промышленность.
Группа 17, известная как группа галогенов, включает в себя элементы с высокой электроотрицательностью. Они образуют сильные кислоты и соли, а также широко применяются в лабораторных и промышленных процессах.
Группа 18, или инертные газы, состоит из элементов, имеющих полностью заполненную внешнюю энергетическую оболочку электронов. Они крайне устойчивы и мало взаимодействуют с другими веществами. Инертные газы широко используются в научных исследованиях, особенно в газовой хроматографии и судовом строительстве.
Таким образом, группы в периодической системе Менделеева играют важную роль в классификации и систематизации элементов. Они позволяют организовать элементы на основе их общих химических свойств, что помогает ученым понять и предсказать поведение элементов и разработать новые соединения и материалы.
Классификация элементов по группам

Периодическая система Менделеева разбита на группы, которые помогают организовать элементы по их химическим и физическим свойствам. Группы в периодической системе представляют собой вертикальные столбцы элементов.
Всего в периодической системе Менделеева есть 18 групп. От 1 до 2 группы относятся к сметаллам - элементам, обладающим металлическими свойствами. Группа 18 представляет инертные газы, которые отличаются высокой стабильностью.
Каждая группа имеет свою общую химическую конфигурацию электронов во внешнем энергетическом уровне, что определяет их химическое поведение. Так, элементы в одной группе имеют схожие химические свойства и образуют химические соединения с аналогичными элементами.
Группы также имеют своеобразное нумерование от 1 до 18. Группы от 1 до 2 называются группами с-элементов и d-элементов соответственно. Группы от 3 до 12 называются группами переходных металлов. Группы от 13 до 18 называются группами родин и группами инертных газов.








