Одновалентный атом - это атом, который имеет только одну электронную оболочку или может образовывать только одну связь с другим атомом.
Одновалентные атомы обладают некоторыми уникальными свойствами, которые важны для понимания их роли в химических реакциях и свойствах веществ. Одним из наиболее известных одновалентных атомов является атом водорода (H), который находится в первой группе периодической таблицы и считается самым простым атомом.
Одновалентные атомы имеют большую реакционную способность из-за отсутствия дополнительных электронных оболочек и легкости с которой они могут образовывать связи с другими атомами. Они часто участвуют в образовании химических соединений и реакциях, что делает их особенно важными для понимания химической реактивности и соединений.
Одним из самых распространенных примеров одновалентного атома является атом калия (K), который находится в первой группе периодической таблицы. Калий имеет одну электронную оболочку и способен образовывать только одну связь с другим атомом. Это позволяет калию образовывать различные соединения, такие как оксиды, нитриды и гидриды при взаимодействии с другими элементами.
Что такое одновалентный атом?
Примером одновалентного атома является водород (H) - самый простой и наиболее распространенный одновалентный атом. Водород образует только одну химическую связь и может образовывать соединения с другими элементами, например, воду (H2O) или метан (CH4).
Одновалентные атомы имеют важное значение в химии и научных исследованиях. Изучение и понимание их химических свойств и возможностей может помочь в разработке новых материалов, лекарств и технологий.
Определение и основные понятия
Одновалентные атомы обычно принадлежат к группе элементов с общей электронной конфигурацией 1s1, что означает наличие одного электрона в валентной оболочке. Примерами одновалентных атомов являются литий (Li), натрий (Na), калий (K), серебро (Ag) и многие другие.
Свойства одновалентных атомов связаны с их способностью образовывать химические соединения с другими атомами. Благодаря своей валентности, они могут образовывать стабильные молекулы с различными элементами, такими как кислород, азот и галогены. Одновалентные атомы также являются важными в составе солей, кислот и оснований, так как они образуют ионы с однозначным зарядом.
Химические свойства одновалентного атома
Одновалентным атомом называется атом с одним валентным электроном во внешней электронной оболочке. У атомов можно выделить три основных типа химических свойств: металлические, амфотерные и неметаллические свойства.
Металлические свойства:
Одновалентные атомы металлов обычно обладают значительным металлическим блеском и проводимостью электричества и тепла. Они легко образуют ионы положительного заряда, отдавая свой валентный электрон другим атомам или ионам. Эти атомы также могут быть деформированы без потери своей структуры кристаллической решетки.
Амфотерные свойства:
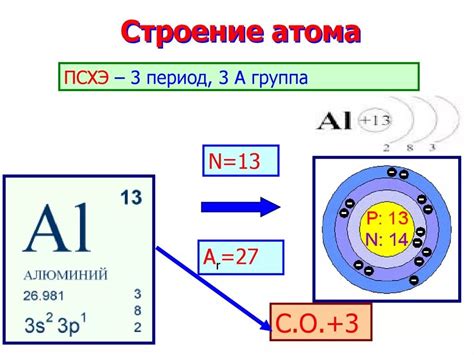
Некоторые одновалентные атомы могут образовывать ионы и положительного, и отрицательного заряда. Такие атомы называются амфотерными. Они способны реагировать и с кислотами, и с основаниями. Например, ион алюминия Al3+ может образовывать соли как с кислотами (AlCl3), так и с основаниями (Al(OH)3).
Неметаллические свойства:
Некоторые одновалентные атомы являются неметаллами и образуют отрицательно заряженные ионы. Они обладают высокой электроотрицательностью и обычно образуют ковалентные связи, в результате которых они разделяют валентные электроны с другими атомами. Примерами одновалентных неметаллов являются кислород (O2-) и хлор (Cl-).
Физические свойства одновалентного атома
Одновалентными называют атомы, у которых во внешней электронной оболочке находится один электрон. Они обладают рядом уникальных физических свойств, которые определяют их химическую активность и взаимодействие с другими элементами.
1. Электронная структура
В случае одновалентных атомов, внешний слой электронов содержит только один электрон. Это делает их особенно реактивными и склонными к образованию химических связей для достижения стабильной электронной конфигурации.
2. Окислительные свойства
Одновалентные атомы имеют сильные окислительные свойства. Из-за наличия только одного электрона во внешней оболочке, они стремятся передать его другим атомам, чтобы достичь постоянной электронной конфигурации.
3. Химическая активность
Одновалентные атомы проявляют высокую химическую активность, так как они стремятся заполнить свой внешний электронный слой или освободить его, вступая в реакции с другими атомами. Это свойство делает их важными участниками в различных химических процессах и реакциях.
4. Физические свойства
Физические свойства одновалентных атомов включают в себя такие параметры, как масса, радиус и плотность. Эти значения могут варьироваться в зависимости от конкретного элемента, но, в целом, атомы с одним электроном обычно обладают малой массой и малым размером.
Обратите внимание, что рассмотренные свойства относятся к идеализированным одновалентным атомам, а не к специфическим химическим соединениям, в которых могут участвовать такие атомы.
Примеры в природе и применение

Примеры одновалентных атомов можно найти во многих природных процессах и материалах.
Одним из наиболее распространенных примеров одновалентных атомов является атом водорода (H). Водород является самым легким и распространенным элементом во всей Вселенной. Он образует соединения с другими элементами, обладая одним ионизированным электроном и одним электроновой оболочкой. Водород широко применяется в промышленности нефтепереработки, химической промышленности, в процессах газоочистки, а также в производстве водородных паливных элементов.
Другим примером одновалентного атома является атом калия (K). Калий обладает одним электроном во внешней оболочке и находится в периодической системе элементов в первой группе. Калий широко применяется в сельском хозяйстве в качестве удобрения. Калийные соединения также используются в производстве стекла, мыла, удобрений и многофункциональных батарей.
Одновалентные атомы также могут быть частью молекул органических соединений. К примеру, молекула этилового спирта (С2Н5ОН) состоит из одного атома кислорода (O), который образует связь с атомом углерода (C) и двумя атомами водорода (H). Этот вид органических соединений широко применяется в медицине, лакокрасочной промышленности, парфюмерии и в производстве растворителей.
Таким образом, одновалентные атомы играют важную роль в природе и имеют широкое применение в различных областях жизни человека.








