Молекулярное и немолекулярное строение – два важных понятия в научной дисциплине химия. Они описывают способ, которым атомы и молекулы организуются и связываются между собой. Понимание этих концепций существенно для понимания химических реакций, свойств веществ и их взаимодействий.
Молекулярное строение – это описание расположения атомов в молекуле. Атомы могут быть связаны между собой различными типами химических связей, такими как ионная, ковалентная или металлическая. Важно отметить, что молекулярное строение определяет свойства вещества, такие как его физическое состояние, температура плавления и кипения, растворимость и т. д.
Например, вода (H2O) – один из наиболее известных примеров молекулы. Ее молекулярное строение состоит из двух атомов водорода, связанных с атомом кислорода. Такое расположение атомов позволяет воде образовывать водородные связи, что делает ее уникальным веществом с высокой температурой плавления и кипения, а также специфическими свойствами растворимости и поверхностного натяжения.
Немолекулярное строение, или кристаллическая структура, описывает способ, которым атомы организуются в кристалле. В отличие от молекулярного строения, в немолекулярном строении атомы могут быть связаны как ковалентными, так и ионными связями, образуя трехмерную решетку. Кристаллическая структура вещества определяет его кристаллическую симметрию и свойства, такие как жесткость, ломкость, прозрачность и оптические свойства.
В конечном счете, понимание молекулярного и немолекулярного строения веществ помогает химикам и исследователям понять свойства и реактивность материалов, разрабатывать новые вещества и применять их в различных областях науки и технологий.
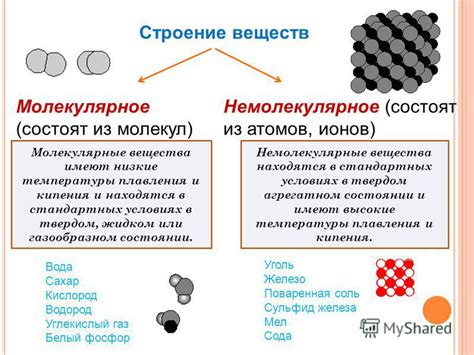
Определение молекулярного и немолекулярного строения

Немолекулярное строение относится к веществам, которые не образуют молекулы, а состоят из атомов, ионов или металлических частиц, расположенных в кристаллической решетке или других упорядоченных структурах.
Молекулы могут быть одноатомными, то есть состоять только из одного вида атомов, или многоатомными, где в молекуле присутствуют разные виды атомов. Примером одноатомных молекул является гелий (He), кислород (O2) и диатомический азот (N2). Многоатомные молекулы включают воду (H2O), углекислый газ (CO2) и глюкозу (C6H12O6).
Молекулярное строение влияет на свойства вещества, такие как агрегатное состояние, температура плавления и кипения, теплоемкость, растворимость в различных средах и т.д. Немолекулярное строение, напротив, определяет особенности заряженных и неупорядоченных частиц, которые могут образовывать кристаллы, металлы или другие упорядоченные структуры со свойствами, отличными от молекулярных веществ.
Молекулярное строение: основные понятия и примеры
Одним из основных понятий молекулярного строения является химическая связь. Химическая связь - это силы, удерживающие атомы вещества вместе. Существуют разные типы химических связей, такие как ковалентная связь, ионная связь и металлическая связь. В виде молекулы атомы связаны в определенной структуре и формируют разные молекулярные соединения.
Ковалентная связь - это тип химической связи, при которой два атома делят одну или несколько электронных пар, образуя связь между собой. Этот тип связи обычно наблюдается в молекулах органических соединений, например, в молекуле воды H2O, где кислородный атом связан с двумя водородными атомами.
Ионная связь - это тип химической связи, при которой атомы передают или получают электроны, образуя положительно и отрицательно заряженные ионы. Этот тип связи часто наблюдается в неорганических соединениях, например, в хлориде натрия NaCl, где натриевый атом с положительным зарядом связан с атомом хлора с отрицательным зарядом.
Металлическая связь - это тип химической связи, характерный для металлов, при которой положительно заряженные ионы металла окружены облаком свободных электронов. Эта связь обеспечивает металлам их характерные свойства, такие как хорошая проводимость электричества и тепла.
Примеры молекул с разными типами молекулярного строения:
- Молекула воды H2O - имеет ковалентную связь между атомами кислорода и водорода. Эта молекула обладает полярностью и способна образовывать водородные связи, что объясняет многие ее химические и физические свойства.
- Молекула хлорида натрия NaCl - имеет ионную связь между положительно заряженным натриевым ионом и отрицательно заряженным ионом хлора. Эта молекула является примером соли и широко используется в пищевой промышленности.
- Молекула железа Fe - имеет металлическую связь, где положительно заряженные ионы железа окружены облаком свободных электронов. Железо является одним из основных металлов, используемых в промышленности и строительстве.
Молекулярное строение имеет огромное значение для понимания свойств вещества и его взаимодействия с другими веществами. Изучение молекулярного строения помогает ученым разрабатывать новые материалы, лекарства и технологии.
Молекулярное строение в химии
Молекулярное строение в химии определяет, как атомы организованы в молекуле и как они связаны друг с другом. Молекулы состоят из атомов, которые могут быть одного или разных элементов.
Существует несколько основных типов связей между атомами в молекулах:
| Тип связей | Описание | Примеры |
|---|---|---|
| Ковалентные связи | Связь, в которой атомы делят электроны | Молекула воды (H2O) |
| Ионные связи | Связь, в которой один атом отдает электроны, а другой атом их принимает | Молекула хлорида натрия (NaCl) |
| Металлические связи | Связь, характерная для металлов, в которой общие электроны перемещаются между атомами | Молекула железа (Fe) |
| Водородные связи | Связь, в которой водородный атом притягивается к электронам соседнего атома | Молекула ДНК |
Молекулярное строение в химии имеет огромное значение, так как оно определяет физические и химические свойства вещества. Например, молекулярное строение воды (H2O) обеспечивает ее свойства, позволяющие ей быть жидкостью при комнатной температуре и обладать высокой способностью растворять другие вещества.
Молекулярная структура органических соединений
Молекулярная структура органического соединения определяется атомным составом и пространственным расположением атомов в молекуле. Молекулярная структура органических соединений имеет важное значение для их свойств и реакционной способности.
В органической химии принято использовать структурные формулы для изображения молекулярной структуры органических соединений. В структурных формулах каждый атом представляется своим символом, причем связи между атомами изображаются линиями. Молекулярные формулы позволяют визуально представить строение органических соединений и легче понять их свойства и реакции.
Молекулярная структура органических соединений может быть разнообразной. Например, в углеводородах, таких как метан (CH4), молекула состоит из одного атома углерода и четырех атомов водорода, связанных между собой с помощью одинарных связей. В органических кислотах, таких как уксусная кислота (CH3COOH), молекула состоит из атомов углерода, водорода и кислорода, связанных между собой разными типами связей.
Молекулярная структура органических соединений может иметь различные конформации и изомеры. Конформации – это различные пространственные конфигурации молекулы, которые могут меняться без разрыва связей. Изомеры – это соединения с одинаковым атомным составом, но различной молекулярной структурой.
Молекулярная структура органических соединений может также включать функциональные группы – это характерные группы атомов, придающие соединению его основные свойства и реакционные возможности.
- Примером молекулярной структуры органического соединения является молекула этилового спирта (C2H5OH), состоящая из атомов углерода, водорода и кислорода, связанных между собой с помощью одинарных связей и одной двойной связи. Этот спирт обладает способностью растворяться в воде и широко используется в промышленности и медицине.
- Другим примером молекулярной структуры органического соединения является молекула глюкозы (C6H12O6), состоящая из шести атомов углерода, двенадцати атомов водорода и шести атомов кислорода, связанных между собой в виде кольца. Глюкоза является основным источником энергии для организма и одним из ключевых веществ в биохимии.
Немолекулярное строение: основные понятия и примеры
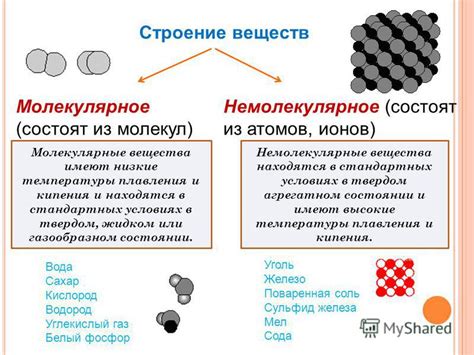
Основными понятиями в немолекулярном строении являются:
- Атомы - основные строительные блоки материи. Атомы состоят из ядра, в котором содержится положительно заряженные протоны и нейтроны, и электронов, которые обращаются вокруг ядра. В немолекулярном строении атомы могут образовывать различные структуры, такие как кристаллические решетки.
- Кристаллическая решетка - это регулярное, упорядоченное расположение атомов или молекул в кристалле. Кристаллические решетки могут иметь различные формы и размеры и проявляться в различных материалах, таких как металлы, минералы или драгоценные камни.
- Межатомные взаимодействия - это силы притяжения или отталкивания между атомами или молекулами. Межатомные взаимодействия играют важную роль в формировании немолекулярного строения и определяют его свойства.
Примерами немолекулярного строения могут служить:
- Кристаллы - такие как соль, алмаз или кварц, которые имеют регулярную геометрическую структуру кристаллической решетки.
- Металлические сплавы - которые состоят из смеси различных металлов и имеют определенную кристаллическую структуру.
- Наночастицы - такие как нанотрубки или наночастицы золота, которые могут иметь необычные формы и свойства из-за своего наномасштабного немолекулярного строения.
Понимание немолекулярного строения является важным для изучения свойств и поведения материалов на микроуровне. Это помогает разрабатывать новые материалы с уникальными свойствами или оптимизировать существующие материалы для различных приложений.
Немолекулярные структуры в биологии
Одной из основных немолекулярных структур, встречающихся в биологии, являются клеточные мембраны. Мембраны разделяют клетки на внутреннюю и внешнюю среду, создавая условия для различных процессов внутри клетки. Клеточные мембраны обладают различными функциями, такими как защита и поддержание структуры клетки, регуляция обмена веществ между клеткой и окружающей средой.
Клеточные органеллы – это другой тип немолекулярных структур. Органеллы – это специализированные области внутри клетки, выполняющие различные функции. Например, митохондрии являются органеллами, ответственными за производство энергии в клетке. Ядро клетки – это еще одна органелла, которая содержит генетическую информацию и управляет большинством клеточных функций.
Немолекулярные структуры также присутствуют на более крупных уровнях организации живых существ. Например, ткани являются структурными компонентами организмов, состоящими из множества клеток, объединенных общими функциями. К примеру, мышцы – это ткани, обеспечивающие движение организма.
Таким образом, немолекулярные структуры играют важную роль в биологии. Они обеспечивают функционирование клеток и организмов в целом, позволяют им выполнять различные задачи и взаимодействовать с окружающей средой.
Примеры молекулярного и немолекулярного строения в природе
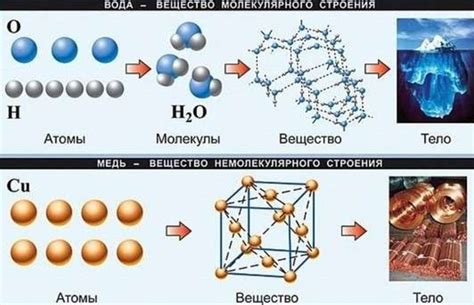
Вода (H2O) – это молекула, состоящая из двух атомов водорода и одного атома кислорода. Вода имеет характерную геометрическую структуру, образуя угол между атомами водорода и кислорода. Это молекулярное строение обуславливает много свойств воды, включая ее способность к водородным связям и высокую поверхностную натяжку.
ДНК – это молекулярная двойная спираль, состоящая из генетической информации. Молекулярное строение ДНК определяет последовательность и расположение ее нуклеотидов. Это позволяет передавать и хранить генетическую информацию в организмах и обеспечивает процессы наследования и размножения.
Немолекулярное строение объединяет частицы, которые не являются молекулами. Они обладают особыми физическими свойствами и формируют сложные структуры. Некоторые примеры в природе:
Кристаллы – это полимеры, образующие простую регулярную решетку атомов или молекул. Кристаллические структуры встречаются в различных минералах и горных породах. Они обладают характеристиками, такими как оптическая прозрачность, твердость и яркие цвета.
Криогенные вещества – это вещества, которые находятся в низкотемпературных состояниях, близких или ниже точки замерзания. Примерами таких веществ являются жидкий азот, гелий и водород. В немолекулярном строении они образуют кристаллические или аморфные структуры, обладающие свойствами, такими как суперпроводимость и сверхпроводимость.








