Катион водорода (H+) - это положительно заряженная частица, состоящая из одного протона и нуля электронов. Отсутствие электронов делает катион водорода очень реакционноспособным и важным веществом для множества химических процессов.
Катионы водорода играют ключевую роль в кислотно-основных реакциях. Они могут донорировать протоны другим веществам, превращаясь при этом в нейтральные молекулы воды. Такие реакции называются протолитическими. Важно отметить, что катионы водорода также могут образовываться в результате реакций воды с другими веществами или при ее электролизе.
Катионы водорода имеют великое значение в живых организмах. Например, они играют роль в процессах дыхания и фотосинтеза. Кроме того, катионы водорода присутствуют во внутренней среде клеток, способствуя поддержанию необходимого pH и регулируя химические реакции внутри организма.
Катион водорода: определение и свойства

Катионы водорода могут образовываться в результате диссоциации молекул воды, когда одна из двух водородных связей прерывается, а образовавшийся протон прочно связывается с одним из оставшихся электронов. Такие процессы возникают при взаимодействии сильных кислот со слабыми основаниями.
Катионы водорода обладают высокой электроносностью и могут легко реагировать с отрицательно заряженными анионами, образуя разнообразные химические соединения. Благодаря своей малой массе, катионы водорода обладают высокой подвижностью в водных растворах, что позволяет им легко перемещаться в пространстве.
Что такое катион водорода
Катион водорода (H+) представляет собой катион, состоящий из одного атома водорода. Он образуется при диссоциации воды и играет важную роль во множестве химических реакций.
Катион водорода является ключевым компонентом в кислотно-основном балансе, где он соперничает с анионом гидроксида (OH-) и содействует поддержанию оптимального pH в растворе. В кислых растворах концентрация катиона водорода выше, чем концентрация аниона гидроксида, в щелочных растворах ситуация обратная, а в нейтральном растворе их концентрации примерно равны.
Катион водорода также активно взаимодействует с множеством других соединений и частиц, влияя на их свойства и поведение. Он может делать молекулы более положительно заряженными, менять степень окисления элементов и влиять на скорость химических реакций. Благодаря этим свойствам катион водорода является ключевым игроком в химической кинетике и реакционных механизмах.
Таким образом, катион водорода играет важную роль в неподсознательной чинии событий, которые происходят в химических системах. Его наличие или отсутствие может оказывать существенное влияние на протекание реакций и позволяет контролировать и регулировать множество химических процессов.
Состав и структура катиона водорода
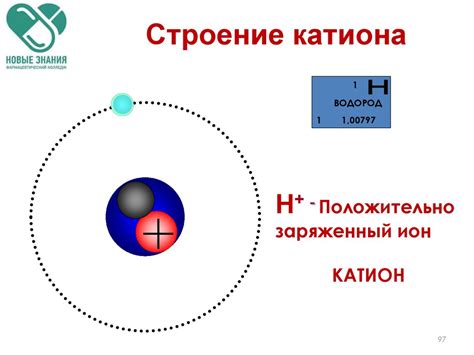
Катион водорода (H+) состоит из одного протона (положительно заряженной частицы) и нуля электронов. Протон находится в центре катиона и окружен облаком электронов других атомов или молекул.
Структура катиона водорода может изменяться в зависимости от окружающей среды и условий реакции. Вместе с другими атомами или молекулами, катион водорода может образовывать химические связи и участвовать в различных реакциях.
Большинство катионов водорода в растворах воды также связаны с молекулами воды, образуя гидрониевые ионы (H3O+). Гидрониевые ионы являются основой для определения кислотности или щелочности растворов, поскольку они играют важную роль в реакциях кислотно-основного равновесия.
Катион водорода играет важную роль в химических реакциях, таких как реакции окисления и восстановления, катализ и образование химических связей. Его свойства и химическую активность определяют его заряд и взаимодействие с другими частицами в реакции.
Физические свойства катиона водорода
Первоначально катион водорода был открыт ранее, чем водород, в ходе экспериментов с электролизом. Он образуется при растворении воды или других растворителей веществ, способных отдавать протоны. Катион водорода является наиболее распространенным источником ионов водорода в растворах.
Любопытно, что катион водорода не обладает собственной химической активностью, хотя его наличие может внести значительные изменения в характер реакции. Он может принимать участие в кислотно-щелочных реакциях, влияя на pH раствора и проявляя свою катализаторную активность.
Физические свойства катиона водорода также связаны с его массой и зарядом. Благодаря своей низкой массе, катион водорода легко движется в растворе и проходит через мембраны. Его наличие может оказывать значительное влияние на физические и химические свойства растворов и вещества в целом.
Важно отметить, что катион водорода, как и другие ионы, обладает высокой электрической проводимостью. Это позволяет использовать его для электролитических процессов, а также для проведения различных аналитических исследований и измерений.
Итак, физические свойства катиона водорода - это его масса, заряд, способность переноситься в растворе и проявлять химическую активность. Эти свойства делают его важным элементом в химических реакциях и взаимодействии веществ, а его наличие в растворе может привести к значительным изменениям в его свойствах и поведении.
Химические свойства катиона водорода

Способность катиона водорода образовывать связи с атомами других элементов позволяет ему участвовать во множестве реакций. Один из наиболее известных примеров - реакция нейтрализации с основаниями. В результате этой реакции катион водорода образует воду взаимодействуя с отрицательно заряженными ионами основания.
Катион водорода также принимает участие в окислительно-восстановительных реакциях, где может выступать как окислитель, так и восстановитель. Например, в реакциях с металлами катион водорода снижает свою степень окисления, переходя в молекулярный водород.
Катион водорода обладает кислотными свойствами и может образовывать кислоты в реакции с соответствующими основаниями. Катионы водорода в кислотах легко переходят от одной молекулы к другой, образуя межмолекулярные водородные связи, что делает кислоты электролитами.
Влияние катиона водорода на реакции окисления-восстановления
Влияние катиона водорода на такие реакции может быть значительным. Присутствие H+ может ускорять скорость химических реакций, раскалывать связи между атомами и изменять структуру вещества. Катион водорода может также участвовать в образовании межфазных границ и передвижении электронов.
Для проведения химических реакций окисления-восстановления требуется наличие катиона водорода, который может быть предоставлен веществами, содержащими воду или кислоты. Присутствие H+ является важным условием для возможности этих реакций.
Окисление и восстановление являются важными процессами во многих биологических и промышленных системах. Например, в организме окисление и восстановление участвуют в процессах дыхания и фотосинтеза. Правильная концентрация катиона водорода в этих системах необходима для поддержания нормального функционирования.
Изучение влияния катиона водорода на реакции окисления-восстановления имеет большое значение для понимания многих химических и биологических процессов. Это позволяет разрабатывать более эффективные катализаторы реакций, улучшать процессы синтеза и получения веществ, а также улучшать качество продуктов и энергоэффективность производственных процессов.
Влияние катиона водорода на кислотно-щелочные реакции
Когда кислотное соединение растворяется в воде, оно отделяет катионы водорода, которые образуют гидроноевые ионы. Эти ионы обладают положительным зарядом и придают раствору кислотные свойства. Катион водорода может быть представлен в кислотных реакциях символом H+ или H+.
Взаимодействие катиона водорода с основанием приводит к кислотно-щелочным реакциям. Катион водорода способен передавать электроны основанию, образуя нейтральные молекулы воды. Это происходит при образовании кислотно-щелочного пары и является основой для нейтрализации кислоты и щелочи.
Кроме того, катион водорода играет важную роль в определении рН раствора. РН-шкала используется для измерения кислотности или щелочности раствора. Чем больше концентрация катионов водорода в растворе, тем ниже будет его рН. Катион водорода является основным показателем кислотности раствора и влияет на химические реакции, происходящие в нем.
Таким образом, катион водорода играет ключевую роль в кислотно-щелочных реакциях. Он определяет кислотность или щелочность раствора, участвует в нейтрализации кислоты и щелочи, а также влияет на химические процессы, происходящие в растворе.








