Кислород - один из самых важных элементов в природе, без которого невозможна жизнь на Земле. Он присутствует в различных формах, таких как молекула, соединение и обладает мощными окислительными свойствами.
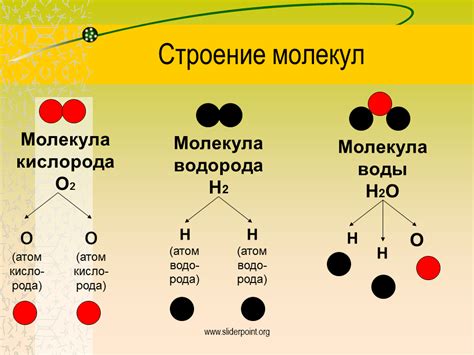
Молекула кислорода (O2) является самой распространенной и стабильной формой существования этого элемента. Она состоит из двух атомов кислорода, связанных ковалентной связью. Эта молекула не только обеспечивает жизнедеятельность организмов, но и является ключевым фактором в химических реакциях, таких как дыхание и горение.
Кислород также может образовывать соединения с другими элементами, образуя оксиды, перекиси и другие соединения. Например, оксид кальция (CaO) является классическим примером оксида, а перекись водорода (H2O2) - пример пероксида. Эти соединения имеют разные свойства и применяются в различных отраслях промышленности, медицине и научных исследованиях.
Одной из главных особенностей кислорода являются его мощные окислительные свойства. Он способен сбраживать другие вещества, нередко приводя к процессам горения. Кроме того, многие химические реакции не могут протекать без его участия. Благодаря своим окислительным свойствам, кислород играет важную роль в жизни всех организмов, а его наличие на Земле - неотъемлемый фактор для поддержания экосистемы и экологического баланса.
Таким образом, форма существования кислорода включает в себя молекулу, соединение и окислительные свойства. Он играет ключевую роль в поддержании жизни и выполнении химических реакций в различных областях науки и пробуждает интерес ученых по всему миру.
Форма существования химического элемента кислорода:
Химический элемент кислород может существовать в различных формах, включая молекулярную форму, соединения с другими элементами и окислительные свойства.
В молекулярной форме кислород образует двухатомные молекулы (O2), которые являются стабильными и составляют около 21% атмосферного воздуха. Эта форма кислорода играет важную роль в поддержании жизни на Земле, так как является необходимым для дыхания организмов.
Кислород также образует множество соединений с другими элементами, включая оксиды (как, например, оксид железа - Fe2O3), кислоты и соли. Эти соединения имеют различные свойства и часто играют важную роль в химических реакциях и промышленных процессах.
Одним из ключевых свойств кислорода является его способность выступать в роли окислителя. Кислород может принять электроны от других веществ, что приводит к окислительной реакции. Это свойство часто используется в химии и технологии, например, при горении или окислительных процессах в батареях и аккумуляторах.
| Соединение | Химическая формула |
|---|---|
| Окись железа(III) | Fe2O3 |
| Вода | H2O |
| Диоксид углерода | CO2 |
| Перекись водорода | H2O2 |
Молекула кислорода:
Молекула кислорода (O2) представляет собой симметричную двугранный газовый молекулу, состоящую из двух атомов кислорода, соединенных сильной двойной ковалентной связью. Каждый атом кислорода имеет внешнюю оболочку, заполненную семью электронами валентной оболочки. В процессе формирования молекулы кислорода, атомы кислорода делят электроны и образуют две связи, приведенные в результате двух палец электронов.
Молекула кислорода является амфотерной и очень реакционной. Она является одним из основных компонентов атмосферы Земли и служит для поддержания жизни на планете. Кроме того, кислород используется в биологических процессах, включая клеточное дыхание, и играет важную роль в окислительно-восстановительных реакциях.
Соединение кислорода:

Кислород также может образовывать соединения с многими другими элементами. Например, оксиды кислорода являются соединениями кислорода с неметаллами, в которых кислород имеет степень окисления -2. Одним из наиболее известных примеров оксидов кислорода является диоксид углерода (CO2), который является основным продуктом дыхания и сгорания органических веществ. Еще одним известным примером оксида кислорода является трехокись азота (N2O3), которая имеет степень окисления кислорода +3. Это красящий газовый оксид, используемый в промышленности и медицине.
Важным классом соединений кислорода являются пероксиды и супероксиды. Перекись водорода (H2O2) является наиболее известным пероксидом кислорода. Она образуется в результате реакции кислорода с водородом и используется в медицине, косметике и промышленности. Супероксиды, такие как пероксид бария (BaO2) и супероксид калия (KO2), имеют степень окисления кислорода -1 и широко используются в химической промышленности и в качестве окислителей.
Окислительные свойства кислорода:
Кислород может окислять различные элементы и соединения, образуя оксиды. Взаимодействие кислорода с металлами приводит к образованию металлических окислов, например, оксида железа (Fe2O3), оксида алюминия (Al2O3) и других. Кроме того, кислород может образовывать оксиды с неметаллами, например, диоксид серы (SO2), диоксид углерода (CO2) и многие другие.
Окислительные свойства кислорода имеют важное значение в различных процессах, происходящих в природе и промышленности. Например, окисление органических веществ в организмах осуществляется с участием кислорода при дыхании. Также кислород используется в промышленности при процессах сжигания топлива и получения энергии.
Кислород в органических соединениях:

Органические соединения, содержащие атомы кислорода, называются органическими оксигруппами. Они могут быть представлены различными функциональными группами, такими как гидроксильные группы (-OH), карбоксильные группы (-COOH) и эфирные группы (-O-).
Гидроксильные группы придают органическим соединениям свойства алкоголей и фенолов. Они обладают поларностью и способностью образовывать водородные связи, что делает их растворимыми в воде и служит основой для многих биологических и химических процессов.
Карбоксильные группы являются основой для образования карбоновых кислот. Они обладают кислотными свойствами, что позволяет им реагировать с основаниями и образовывать соли – карбоксилаты.
Эфирные группы, содержащие кислород и не содержащие водородных атомов, являются основой для формирования эфиров. Они обладают низкой поларностью, что делает их нерастворимыми в воде, и способностью участвовать в различных реакциях в органической химии.
Кислород в органических соединениях может также выступать в качестве фрагмента структуры карбоновых оснований, таких как азот или сера. Такие группы содержат ковалентную связь между кислородом и атомом азота или серы и играют важную роль в многих биологических и химических процессах.
Реакции кислорода в природе:
Одной из основных реакций кислорода в природе является его участие в горении. Воздух, состоящий преимущественно из азота и кислорода, необходим для возгорания большинства органических веществ. Процесс горения заключается в окислении органических молекул кислородом и является одним из основных источников энергии в природе.
Кроме того, кислород играет важную роль в биохимических процессах. Водоросли и растения, благодаря процессу фотосинтеза, преобразуют углекислый газ и воду с помощью энергии солнечного света в органические вещества и кислород. Таким образом, кислород является не только необходимым для жизни существам, но и производителем кислорода.
Кислород также участвует в процессе окисления, при котором многие вещества подвергаются химическим реакциям с кислородом. Например, разложение органического материала в почве, окисление железа в ржавчину или окисление пищевых продуктов в организме человека – все это процессы, связанные с участием кислорода.
Взаимодействие кислорода с металлами:
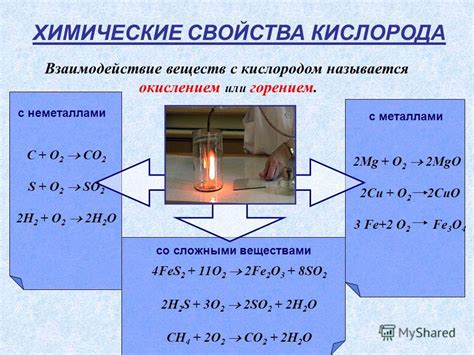
Кислород обладает сильными окислительными свойствами, поэтому активно взаимодействует с большинством металлов. В процессе этого взаимодействия образуются оксиды металлов, которые могут иметь различную природу и степень окисления.
Например, при обычных условиях кислород реагирует с железом, образуя оксид железа (Fe2O3), который называется ржавчиной. Это хорошо известное явление окисления железа, которое называется коррозией.
Кислород также может взаимодействовать с алюминием, образуя оксид алюминия (Al2O3), который является прочным и стойким материалом и служит основой для защитной пленки на поверхности алюминиевого металла.
Взаимодействие кислорода с другими металлами может приводить к образованию различных оксидов, таких как оксид цинка (ZnO), оксид меди (CuO), оксид свинца (PbO) и многих других.
Важно отметить, что взаимодействие металлов с кислородом может происходить только при наличии доступа кислорода к поверхности металла. Поэтому, например, хорошо защищенные от окружающей среды металлические изделия могут быть стойкими к коррозии, так как доступ кислорода ограничен или полностью исключен.
Кислород в атмосфере Земли:
Основной источник кислорода в атмосфере - фотосинтез, который осуществляется зелеными растениями и водорослями. В процессе фотосинтеза растения поглощают углекислый газ и выделяют в атмосферу кислород.
Кислород в атмосфере играет важную роль для жизни на Земле. Он является необходимым для дыхания организмов, включая животных и людей. Кислород также участвует в окислительно-восстановительных процессах, влияя на состав атмосферы и климат.
Изменение концентрации кислорода в атмосфере может иметь серьезные последствия для биосферы и климата планеты. Именно поэтому важно следить за состоянием атмосферы и балансом кислорода в ней.
Роль кислорода в живых организмах:

Главной функцией кислорода является его участие в окислительных процессах, происходящих в клетках организма. В процессе клеточного дыхания, кислород осуществляет окисление органических веществ, таких как глюкоза, в результате чего выделяется энергия, необходимая для жизни организма.
Кроме этого, кислород играет важную роль в обмене газами. В легких кислород попадает в кровь, а затем распределяется по всем клеткам организма, обеспечивая их дыхание. Кислород также участвует в образовании атмосферного электричества, влияет на погоду и климат, а также осуществляет очистку атмосферы от загрязнений.
Однако, кислород может также проявлять окислительные свойства и наносить вред организму. Во время окисления органических веществ, в том числе и внутри организма, образуются свободные радикалы, которые могут повреждать клетки и вызывать различные заболевания. Поэтому наш организм обладает системой антиоксидантной защиты, которая предотвращает повреждения от свободных радикалов и поддерживает баланс окислительно-восстановительных процессов.
Применение кислорода в промышленности:
Одним из основных применений кислорода является его использование в производстве стали. Кислород используется в качестве окислителя при дутье жидкой стали. Он увеличивает процент примесей, таких как углерод и сера, в стали, что делает ее более прочной и устойчивой к коррозии. Кроме того, кислород позволяет снизить количество необходимого кокса и повысить эффективность процесса производства стали.
Кислород также находит применение в процессе сварки и резки металлов. Он используется в качестве окислителя для повышения температуры горения газовой смеси, что позволяет более эффективно выполнять сварочные и резательные работы.
Кроме того, кислород используется в производстве стекла, в процессах окрашивания и обесцвечивания материалов, в производстве химических веществ, в процессе очистки сточных вод и в медицинской промышленности для поддержания дыхания пациентов.








