Энтальпия - важное понятие в химии, которое является мерой изменения энергии системы во время процесса. В некоторых случаях энтальпия может быть больше нуля, что означает, что система поглощает тепло и испытывает изменение внутренней энергии.
Одной из причин положительной энтальпии является эндотермический процесс. Во время такого процесса система поглощает тепло из окружающей среды, что приводит к увеличению ее энергии. Примерами эндотермических процессов являются растворение соли в воде или испарение жидкости в газообразное состояние.
Другим фактором, влияющим на положительную энтальпию, является высокая температура системы. При повышении температуры молекулы вещества получают больше энергии и начинают колебаться быстрее. Это приводит к увеличению энтальпии и изменению физических свойств системы.
Понимание значимости положительной энтальпии важно для различных областей науки и промышленности. Знание значений и эффектов положительной энтальпии позволяет улучшать производственные процессы, разрабатывать новые материалы и повышать эффективность химических реакций.
Позитивная энтальпия: основные причины и ее значение

Основные причины, приводящие к возникновению позитивной энтальпии, включают:
- Химические реакции. Многие химические реакции сопровождаются выделением или поглощением тепла. Если в результате реакции система поглощает больше тепла, чем отдает, энтальпия будет положительной.
- Изменение агрегатного состояния вещества. При переходе вещества из одного агрегатного состояния в другое происходят изменения внутренней энергии системы, что влияет на ее энтальпию.
- Изменение температуры. При нагреве системы энтальпия обычно увеличивается, так как она поглощает тепло. Также, при повышении температуры, может происходить изменение фазового состояния вещества, что также влияет на энтальпию.
Значение позитивной энтальпии заключается в следующем:
- Позволяет оценить энергетическую потребность или выходную энергию реакции.
- Является основным показателем направленности процессов. Положительная энтальпия может указывать на эндотермическую реакцию, которая требует постоянного поступления энергии.
- Важна для определения оптимальных условий проведения реакции или процесса. Зная знак энтальпии, можно выбрать подходящие условия, чтобы получить требуемый продукт или эффект.
В целом, позитивная энтальпия является неотъемлемой частью химических реакций и процессов, и ее исследование и понимание играют важную роль в различных областях науки и промышленности.
Адсорбция и энтальпия
Энтальпия – это физическая величина, которая определяет количество энергии, которое может быть перенесено или получено системой во время химической реакции или физического процесса. Энтальпия может быть рассчитана с использованием закона сохранения энергии.
Отношение между адсорбцией и энтальпией заключается в том, что при адсорбции происходит освобождение или поглощение тепла. Это изменение энтальпии может быть положительным или отрицательным в зависимости от типа адсорбции.
Положительное изменение энтальпии во время адсорбции указывает на то, что процесс адсорбции является эндотермическим, то есть требует поглощения тепла. Это может происходить, например, когда вещество при адсорбции испаряется с поверхности адсорбента.
С другой стороны, отрицательное изменение энтальпии во время адсорбции указывает на то, что процесс адсорбции является экзотермическим, то есть сопровождается выделением тепла. Это может происходить, например, когда вещество при адсорбции связывается с поверхностью адсорбента.
Изменение энтальпии во время адсорбции имеет большое значение, так как оно может влиять на скорость и эффективность процесса адсорбции. Кроме того, знание изменения энтальпии может помочь в понимании химических и физических свойств веществ и использоваться для оптимизации процессов адсорбции в различных областях науки и техники.
Химические реакции с положительной энтальпией

Химические реакции с положительной энтальпией относятся к таким случаям, когда энтальпия системы увеличивается в процессе реакции. Это означает, что реакция требует поглощения тепла из окружающей среды для протекания.
Одним из примеров такой реакции является химическое сгорание. В процессе горения, например, углеводородов, происходит окисление этих веществ с образованием более стабильных веществ, таких как углекислый газ и вода. В этом случае, энергия, выделяющаяся при образовании таких продуктов, является источником дополнительного тепла и позволяет реакции протекать.
Положительная энтальпия также свойственна эндотермическим реакциям. В таких реакциях система поглощает тепло из окружающей среды, чтобы изменить свои состояния или образовать новые вещества. Примером эндотермической реакции может быть взаимодействие между аммиаком и кислородом, при которой образуется азотную кислоту. Эта реакция характеризуется поглощением тепла окружающей среды и увеличением энтальпии системы.
Химические реакции с положительной энтальпией имеют важное значение в жизни организмов. Одним из примеров таких реакций является синтез АТФ в клетках живых организмов. В этом процессе, энергия, полученная от реакции с разложением молекулы АТФ, используется для совершения различных биологических процессов. Таким образом, реакции с положительной энтальпией играют важную роль в обмене энергией, обеспечивая жизнедеятельность организмов.
Экзотермические процессы и энтальпия
Энтальпия обозначается символом H и определяется как сумма внутренней энергии и произведения давления на объем системы. Положительные значения энтальпии указывают на поглощение тепла или энергии, а отрицательные значения - на выделение тепла или энергии. В экзотермических процессах энтальпия имеет отрицательное значение, что указывает на выделение тепла или энергии в окружающую среду.
Чтобы лучше понять значение экзотермических процессов и энтальпии, можно рассмотреть пример горения. Горение характеризуется выделением тепла и света, что указывает на экзотермическую реакцию. В процессе горения происходит окисление вещества, при этом происходит изменение энергии и энтальпии системы.
Основное значение экзотермических процессов и энтальпии заключается в возможности использования этих реакций для получения энергии. Например, сжигание угля или дров является экзотермической реакцией, в ходе которой выделяется тепло. Это тепло можно использовать для обогрева помещений или привода паровых двигателей.
| Примеры экзотермических процессов | Значение энтальпии |
|---|---|
| Горение | Отрицательное |
| Кристаллизация | Отрицательное |
| Выделение энергии при растворении | Отрицательное |
Таким образом, понимание экзотермических процессов и значением энтальпии позволяет применять эти реакции в различных областях, от химической промышленности до энергетики, что способствует эффективному использованию энергии и ресурсов.
Термодинамические свойства и энтальпия
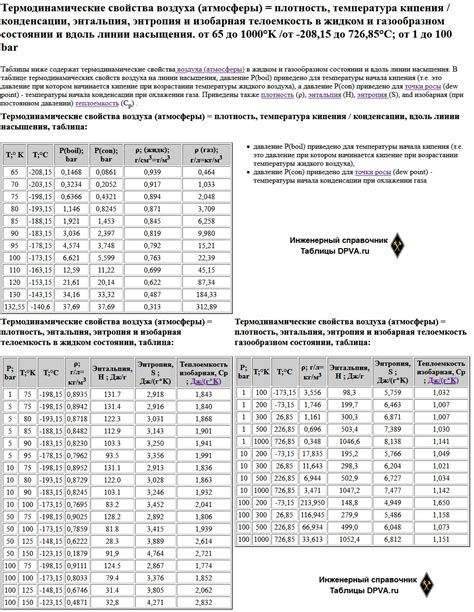
Энтальпия - это термодинамическая функция, которая определяет количество тепла, поглощенного или выделяющегося при проведении химической реакции или изменении состояния вещества при постоянном давлении. Она является мерой энергетического состояния системы и позволяет оценить изменение энергии, происходящее в ходе реакции или процесса.
Знание энтальпии позволяет предсказывать направление и интенсивность химических реакций, а также оптимизировать условия их проведения. Большинство химических реакций сопровождаются изменением энтальпии. Положительное значение энтальпии (эндотермическая реакция) указывает на поглощение тепла системой, в то время как отрицательное значение энтальпии (экзотермическая реакция) соответствует выделению тепла.
Причины положительного значения энтальпии в различных системах могут быть разными. Энергия, поглощаемая системой, может расходоваться на различные процессы, такие как изменение состояния электронов, атомов или молекул, разрушение или образование химических связей и др. Наличие положительной энтальпии не означает, что система потребляет тепло из внешней среды. Может быть и другая причина, например, поглощение работы системой или изменение ее объема.
Значение энтальпии имеет важное значение в термодинамике и в химии. Оно используется для расчетов энергетических параметров реакций, таких как тепловые эффекты, стандартные энтальпии образования и сгорания веществ, а также для определения энергии связи.
Практическое применение энтальпии больше нуля
1. Химические реакции:
Энтальпия больше нуля позволяет определить, необходимое количество энергии для протекания химической реакции. Положительное значение энтальпии указывает на эндотермическую реакцию, что означает поглощение тепла из окружающей среды. Такие реакции часто используются в синтезе различных веществ и материалов.
2. Термодинамика и энергетика:
Энтальпия больше нуля играет важную роль в термодинамических расчетах и энергетике. Разница между энтальпиями входящих и выходящих веществ в реакции позволяет оценить количество выделяющейся или поглощаемой тепловой энергии. Этот параметр учитывается при проектировании и расчете энергетических установок, таких как теплообменники, котлы и двигатели.
3. Фазовые переходы:
Энтальпия больше нуля также учитывается при изучении фазовых переходов вещества. При переходе из одной фазы в другую может происходить изменение энтальпии, что может оказывать влияние на физические свойства материала. Например, энтальпия парообразования определяет количество тепла, необходимое для перехода вещества из жидкой фазы в газообразную.
4. Проектирование процессов:
Знание энтальпии больше нуля позволяет оптимизировать и проектировать различные процессы. С учетом энтальпийных изменений можно предсказать энергетическое эффективность процесса и выбрать наиболее эффективные параметры.
Таким образом, понимание и использование энтальпии больше нуля имеет существенное значение в химии, термодинамике и различных инженерных отраслях, где важно учитывать энергетические аспекты процессов.








