Химия – наука, изучающая строение, свойства и превращения веществ. Она помогает нам понять, как работает мир вокруг нас, почему разные вещества ведут себя по-разному и как можно изменять их состав и свойства.
Одним из ключевых понятий в химии является химическое явление. Это процесс, при котором происходит превращение одних веществ в другие под воздействием различных факторов, таких как температура, давление или добавление других веществ. Химические явления происходят повсюду в нашей жизни – от процессов, происходящих в организмах живых существ, до реакций, происходящих в промышленных процессах.
Примером химического явления может служить горение. При горении происходит реакция между веществами и окислителем, в результате чего выделяется тепло и образуются новые вещества. Например, при сжигании древесины воздухом образуется углекислый газ и вода. Другим примером химического явления является образование ржавчины на металлической поверхности под воздействием влаги и кислорода. При этом образуются оксиды металла, которые имеют обрушивающее действие на металл.
Химические явления играют важную роль во многих сферах нашей жизни – от производства пищи и лекарств до разработки новых материалов и технологий. Изучение химии позволяет узнать о множестве удивительных процессов и явлений, которые происходят вокруг нас каждый день.
Важно отметить, что химические явления подчиняются определенным законам и принципам, описанным в химической науке. Изучение этих законов позволяет предсказывать и понимать различные химические реакции, а также разрабатывать новые способы синтеза и модификации веществ. Понимание значимости химических явлений позволяет создавать новые материалы, лекарства и технологии, которые применяются во всем мире.
Роль химических явлений в нашей жизни

Химические явления играют значительную роль в нашей жизни и оказывают влияние на многие аспекты нашего повседневного существования. Они определяют свойства веществ, происходящие реакции и обеспечивают наш организм необходимыми веществами.
Примеры химических явлений в нашей жизни:
1. Пищеварение: Химические процессы пищеварения разлагают пищу на молекулы, которые тело может усваивать. Например, при воздействии на пищу желудочным соком соляной кислоты происходит расщепление белков на аминокислоты.
2. Ожоги: При ожогах происходит реакция окисления, которая приводит к повреждению тканей. Средства от ожогов являются химическими веществами, которые помогают уменьшить воспаление и ускорить заживление ран.
3. Фотосинтез: В ходе фотосинтеза растения преобразуют солнечную энергию, углекислый газ и воду в органические вещества, такие как глюкоза. Это позволяет растениям получать питательные вещества и отделять кислород в атмосферу, что важно для нашего дыхания.
4. Сгорание топлива: При сгорании топлива происходит окислительно-восстановительная реакция, результатом которой являются энергия, углекислый газ и вода. Топливо используется для привода двигателей и обогрева, обеспечивая нашу мобильность и комфорт.
Это лишь небольшой перечень примеров, которые показывают, как химические явления влияют на наши ежедневные действия и физическое состояние. Изучение химии позволяет нам лучше понять и контролировать эти процессы, что важно для нашего благополучия и развития науки и технологии.
Основные понятия и примеры
В химии существует несколько основных понятий, которые помогают понять и описать различные химические явления. Рассмотрим некоторые из них:
- Вещество – материя, которая имеет массу и объем, и может быть описана определенными физическими и химическими свойствами. Примеры веществ: вода, соль, кислород.
- Элемент – вещество, состоящее из одного типа атомов. Все элементы представлены в периодической системе химических элементов. Примеры элементов: кислород (O), углерод (C).
- Соединение – вещество, состоящее из двух или более элементов, объединенных химической связью. Примеры соединений: вода (H2O), соль (NaCl).
- Смесь – система, состоящая из двух или более веществ, которые не соединены химически и могут быть разделены физическими методами. Примеры смесей: воздух, сахарный раствор.
- Химическая реакция – процесс превращения одних веществ в другие под воздействием химических факторов. Примеры химических реакций: сгорание древесины, окисление железа.
Эти понятия являются основой для понимания и изучения химических явлений. Они позволяют классифицировать и описывать вещества, а также объяснять и предсказывать химические реакции.
Формирование связей и молекулярная структура
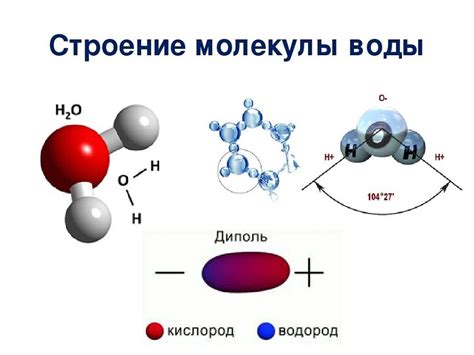
Химическая связь – это силовое взаимодействие, которое удерживает атомы или ионы в молекуле или кристаллической решетке. Формирование связей происходит при обмене или общем использовании электронов в внешних оболочках атомов. Основные типы химических связей включают ионную связь, ковалентную связь и металлическую связь.
Молекулярная структура определяет ее физические и химические свойства. Она может быть линейной, плоскостной или трехмерной. Молекула может состоять из одного или нескольких видов атомов, и ее форма определяется расположением этих атомов в пространстве. Например, вода имеет трехмерную структуру из атомов кислорода и водорода.
Формирование связей и молекулярная структура важны для понимания многих явлений в химии. Они объясняют, как происходят реакции между веществами, как образуются новые соединения и как меняются их свойства. Изучение этих понятий помогает расширить наши знания о мире вокруг нас и применить их в повседневной жизни.
Реакции и превращения веществ
Реакции могут проходить при взаимодействии различных химических веществ или при воздействии на них физических факторов, таких как температура, давление или освещение.
Реакции и превращения веществ разделяют на необратимые и обратимые. В необратимых реакциях исходные вещества превращаются в новые вещества, при этом исходные вещества не могут быть восстановлены из полученных продуктов. Примером необратимой реакции является горение бумаги или дерева.
В обратимых реакциях исходные вещества образуют продукты, которые в свою очередь могут превратиться обратно в исходные вещества при определенных условиях. Примером обратимой реакции является обратимая конденсация водяного пара.
Превращения веществ могут проходить в различных фазах – газовой, жидкой или твердой. В зависимости от условий и свойств вещества, реакции могут сопровождаться выделением или поглощением тепла, изменением объема, образованием новых веществ или разрушением структуры уже имеющихся.
Реакции и превращения веществ играют важную роль в различных сферах жизни и науки, включая промышленность, медицину, пищевую отрасль и синтез новых материалов.
Окислительно-восстановительные процессы
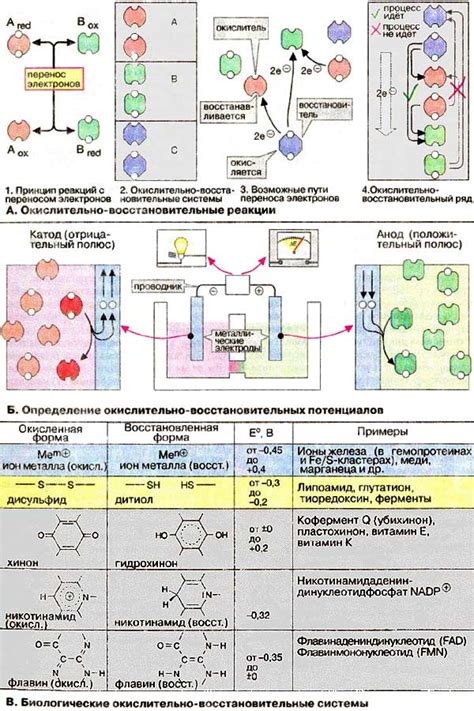
В реакциях окисления вещество теряет электроны и повышает свой степень окисления. В то же время, в реакциях восстановления вещество получает электроны и снижает свой степень окисления.
Примером окислительно-восстановительной реакции является горение – процесс окисления органических веществ при контакте с кислородом. В результате горения, органические вещества окисляются до оксидов, а кислород восстанавливается до воды.
Другим примером такой реакции является взаимодействие металлов с кислотами. Металл окисляется, теряя электроны, а кислород из кислоты восстанавливается до воды или кислородного газа.
Окислительно-восстановительные процессы широко применяются в промышленности. Они используются для производства электроэнергии, синтеза органических веществ, очистки воды и многих других процессов.
Энергия и тепловые явления
Тепловая энергия определяется как кинетическая энергия частиц вещества, связанная с их тепловыми движениями. При химических реакциях тепловая энергия может выделяться (экзотермические реакции) или поглощаться (эндотермические реакции).
В процессе экзотермической реакции тепловая энергия, выделяющаяся при разрыве и образовании химических связей, передается окружающей среде в виде тепла. Экзотермические реакции часто сопровождаются выделением света или нагревом.
Эндотермические реакции, напротив, поглощают тепловую энергию из окружающей среды. Такие реакции требуют постоянного подвода энергии для их протекания. Однако, эндотермические реакции могут быть использованы для поглощения лишней теплоты и охлаждения окружающего пространства.
- Примером экзотермической реакции является взаимодействие металла с кислородом в результате горения. При этом выделяется тепло и образуется оксид металла.
- Примером эндотермической реакции является процесс плавления льда. Для перехода из твердого состояния в жидкое требуется поглощение теплоты из окружающей среды.
Знание об энергетических процессах и тепловых явлениях позволяет контролировать и использовать химические реакции в промышленности, экологии, медицине и других сферах деятельности.








