Окисление - это химический процесс, который происходит при взаимодействии вещества с кислородом или другим окислителем. В результате окисления вещество теряет электроны и повышает свою окислительность.
Окисление является одной из основных реакций в химии и происходит в различных процессах. Это может быть окисление металлов, горение органических веществ, окисление алкоголя и многое другое.
Окисление часто сопровождается выделением энергии в виде света или тепла. Например, при горении кислород окисляет органические вещества, и в результате выделяется энергия в виде света и тепла.
Реакция окисления может протекать с различной интенсивностью. Некоторые вещества окисляются очень быстро, создавая взрывоопасные реакции, а другие окисляются медленно и без видимых изменений.
Окисление играет важную роль в жизни организмов. Например, в организмах животных и растений происходят сложные процессы окисления, которые обеспечивают их жизнедеятельность. Это процессы, связанные с дыханием, окислением пищи, и выделением энергии. В биологии окисление часто сравнивают с горением, которое происходит без пламени и без мгновенного уничтожения вещества.
Таким образом, окисление - это важный процесс в химии и биологии, который обусловлен взаимодействием вещества с кислородом или другими окислителями. Он может происходить различными способами и играет важную роль в жизни организмов и технологических процессах.
Окисление в химии
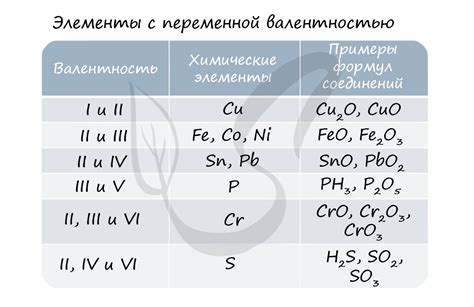
Окисление обуславливается различными процессами, включая реакции с кислородом, перекисями и окислителями. Кислород может вступить в реакцию напрямую, например, при горении, или через перекисные связи. Окислители, такие как хлор или кислородная вода, также способны окислять вещества.
Важно отметить, что окисление и восстановление являются сопряженными процессами. Восстановление - это обратный процесс, при котором вещество получает электроны и изменяет свою степень окисления в более низкую.
Окисление имеет большое значение в химии, так как многие реакции и процессы в органической и неорганической химии связаны с изменением степени окисления вещества. Эти реакции могут быть как спонтанными, так и управляемыми с помощью катализаторов и энергии.
Окисление имеет широкий спектр применений в различных областях, включая промышленность, медицину, пищевую промышленность и энергетику. Это также играет важную роль в жизни организмов, так как многие биохимические процессы, включая дыхание, связаны с окислением и восстановлением веществ.
Основные понятия и определения
Восстановление - это химический процесс, при котором вещество получает электроны и уменьшает свой степень окисления.
Электрон - элементарная частица, обладающая отрицательным зарядом, которая участвует в окислительно-восстановительных реакциях.
Вещество - это субстанция или смесь химических элементов и соединений, обладающая массой и объемом.
Степень окисления - это числовой показатель, отражающий количество электронов, переданных атомом или ионом вещества при окислительно-восстановительной реакции.
Оксид - это химическое соединение, содержащее кислород и другие элементы, которое образуется в результате окисления.
Окислитель - это вещество, которое при окислительно-восстановительной реакции принимает электроны от другого вещества.
Восстановитель - это вещество, которое при окислительно-восстановительной реакции отдает электроны другому веществу.
Окислительное средство - это вещество, которое способствует окислению другого вещества, само при этом восстанавливаясь.
Восстановительное средство - это вещество, которое способствует восстановлению другого вещества, само при этом окисляясь.
Окислительно-восстановительная реакция - это химическая реакция, в результате которой происходит одновременное окисление одних веществ и восстановление других.
Электронный перенос и окислительно-восстановительные реакции

ОВПр состоят из двух основных компонентов: окислительного и восстановительного агентов. Окислительный агент, также известный как окислитель, принимает электроны от вещества, которое окисляется. В то же время, восстановительный агент, или восстановитель, отдает электроны окислителю. При этом, окислитель теряет электроны (окисление), а восстановитель приобретает электроны (восстановление).
В процессе окисления одного вещества другое вещество претерпевает восстановление и наоборот, в результате образуются окисленное и восстановленное вещества. ОВПр могут проходить в различных средах, включая растворы, газы и твердые вещества.
Окислительно-восстановительные реакции широко применяются в промышленности и в других отраслях. Они служат основой таких процессов, как гальваническое покрытие, электролиз, батареи и аккумуляторы. Также ОВПр являются основой для многих биологических процессов, включая дыхание, фотосинтез и многое другое.
Окислительно-восстановительные реакции можно описать и с помощью специального способа представления - полуреакций. В полуреакциях показывается, какие атомы или ионы получают или теряют электроны, а также какие изменения происходят в оксидационном состоянии вещества.
Таблица ниже показывает несколько примеров окислительно-восстановительных реакций, а также соответствующие полуреакции:
| ОВПр | Окислительный агент (окислитель) | Восстановительный агент (восстановитель) |
|---|---|---|
| 2Na + Cl2 → 2NaCl | Cl2 | 2Na |
| CuO + H2 → Cu + H2O | CuO | H2 |
| Fe2+ + Ce4+ → Fe3+ + Ce3+ | Ce4+ | Fe2+ |
Приведенные примеры показывают, как различные окислительные и восстановительные агенты изменяют свои оксидационные состояния и взаимодействуют друг с другом в окислительно-восстановительных реакциях.
Электронный перенос и окислительно-восстановительные реакции играют важную роль в многих аспектах химии и имеют широкий спектр применений. Изучение этих процессов позволяет понять фундаментальные принципы реакций и разрабатывать новые методы синтеза веществ и материалов.
Окисление и восстановление вещества
Окисление и восстановление обусловлены наличием оксиданта и восстановителя соответственно. Оксидант - это вещество, которое принимает электроны от окисляемого вещества, а восстановитель - вещество, которое отдает электроны окислителю.
Процессы окисления и восстановления играют важную роль в различных сферах, таких как химическая промышленность, пищевая промышленность, медицина и даже в биологии организмов.
Окисление вещества может привести к образованию новых соединений, изменению их физических и химических свойств, а также возникновению различных видов реакций, таких как горение, коррозия, деградация. В тоже время, процесс восстановления позволяет восстановить структуру и функции окисленных веществ, а также устранить негативные последствия окисления.
Окисление и восстановление вещества являются неотъемлемыми компонентами многих химических реакций и важными для понимания и применения в различных областях науки и техники.
Классификация окислительно-восстановительных реакций
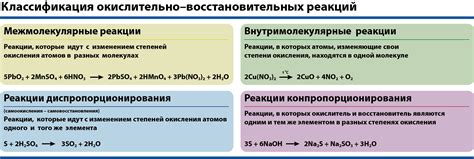
Окислительно-восстановительные реакции в химии могут быть классифицированы по различным признакам. Один из принятых способов классификации базируется на изменении степени окисления вещества.
Данная классификация включает в себя четыре основных типа окислительно-восстановительных реакций:
| Тип реакции | Описание |
|---|---|
| Прямая окислительно-восстановительная реакция | В процессе данного типа реакции происходит прямое взаимодействие окислителя с восстановителем. Окислитель получает электроны от восстановителя, после чего происходит образование окисленного вещества и восстановленного вещества. |
| Индиректная окислительно-восстановительная реакция | В этом типе реакции сначала происходит образование промежуточного соединения, которое затем взаимодействует с окислителем или восстановителем. После взаимодействия образуются окисленное и восстановленное вещества. |
| Аутокаталитическая окислительно-восстановительная реакция | В данном случае одно и то же вещество выступает одновременно в роли окислителя и в роли восстановителя. Процесс протекает автокаталитически, без участия других веществ. |
| Реакция диспропорционирования | В этом типе реакции одно и то же вещество окисляется и восстанавливается одновременно, образуя разные продукты. В результате происходит "распрокидывание" вещества по степени окисления. |
Такая классификация помогает систематизировать различные окислительно-восстановительные реакции в химии и понять основные принципы, лежащие в их основе.
Окисление органических и неорганических веществ
Окисление органических веществ происходит в молекулах, которые содержат углерод. В таких реакциях активное кислородное вещество вступает в контакт с органическим веществом и принимает углеродные электроны, а органическое вещество теряет их. Такие процессы, например, встречаются при дыхании организмов, в процессе горения органических материалов или окисления алкоголя в организме человека.
Окисление неорганических веществ возможно в реакциях с кислородом или другими окислительными веществами. Например, металлы могут окисляться при взаимодействии с кислородом воздуха, образуя металлические оксиды. Эти реакции широко используются в промышленности, например, при производстве стали. Также окисление может происходить при взаимодействии неорганических веществ, например, кислоты и основания могут окисляться в присутствии окислителей.
Основные характеристики окислительных процессов

Важной характеристикой окислительных процессов является наличие вещества, называемого окислителем (вещество, придающее электрон), и вещества, которое окисляется (вещество, отдавшее электрон). Окисление представляет собой процесс передачи электрона от окислителя к окисляемому веществу.
Во время окисления происходит увеличение окислительного состояния окисляемого вещества, а также снижение окислительного состояния окислителя. Окисление сопровождается выделением энергии и может протекать в аэробных (с участием кислорода) или анаэробных (без участия кислорода) условиях.
Окислительные процессы имеют важное значение во многих областях химии, включая органическую, неорганическую и физическую химию. Эти процессы играют особую роль в биологических системах, таких как дыхание, фотосинтез и окислительное фосфорилирование.
Понимание основных характеристик окислительных процессов позволяет более глубоко изучить реакции, проводимые в химии, а также их влияние на окружающую среду и биологические системы.








