Атом - основная единица вещества, состоящая из ядра и электронной оболочки. Один из ключевых аспектов атомной структуры - его валентность. Валентность атома определяет его способность вступать в химические реакции.
Валентность атома определяется числом внешних электронов, находящихся на его электронной оболочке. Валентные электроны - это электроны, участвующие в химических взаимодействиях с другими атомами. Они определяют, какие связи может образовать атом и какие соединения он может формировать.
Валентность атома влияет на его химическую активность и реакционную способность. Атомы стремятся заполнить свою валентную оболочку, переходя в более устойчивое энергетическое состояние.
Валентные электроны в атоме могут образовывать химические связи с электронами других атомов, образуя так называемые химические соединения. Эти соединения могут быть ионными, ковалентными или металлическими в зависимости от природы взаимодействия электронов.
Понимание валентных возможностей атома является ключевым для понимания химических свойств вещества и его применения в различных областях науки и технологий. Изучение валентности атомов позволяет предсказывать химические свойства веществ, а также создавать новые материалы и соединения с нужными свойствами.
Атом: структура и основные характеристики
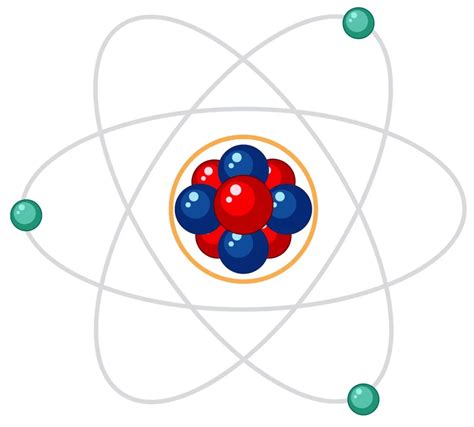
Электроны - частицы с отрицательным зарядом, которые обращаются по орбитам вокруг ядра атома. Они определяют химические свойства вещества и отвечают за проводимость электрического тока.
Протоны - частицы с положительным зарядом, которые находятся в ядре атома. Количество протонов в атоме определяет его атомный номер и химическую природу элемента.
Нейтроны - частицы без заряда, которые также находятся в ядре атома. Они способствуют устойчивости ядра и определяют его массовый номер.
Основные характеристики атома включают атомный номер (Z), который соответствует количеству протонов в атоме, и атомную массу (A), которая определяется суммой протонов и нейтронов в атоме.
Атомы различных элементов могут иметь разное количество электронов, протонов и нейтронов, что делает их химически разными. Эти различия в свойствах атомов и их взаимодействиях обусловливают разнообразие химических соединений и материалов в нашем мире.
Важно отметить, что в атоме существуют и другие элементарные частицы, такие как кварки и лептоны, но в рамках данной статьи мы ограничимся рассмотрением основных компонентов атома.
Электроны: их роль и распределение в атоме
Роль электронов в атоме очень важна. Именно их распределение определяет химические свойства элементов и возможность образования химических связей. Каждый электрон характеризуется набором определенных квантовых чисел, которые определяют его энергетический уровень и орбиталь.
Распределение электронов в атоме происходит в соответствии с принципом заполнения подуровней, который определяет порядок, в котором электроны заполняют орбитали атома. Наиболее близким к ядру находятся s-орбитали, затем следуют p-, d- и f-орбитали. Каждая орбиталь может содержать определенное число электронов в соответствии с правилом Паули и принципом нескольких электронов.
Распределение электронов можно представить в виде электронной конфигурации, которая указывает, сколько электронов находится на каждом энергетическом уровне и в каждой орбитали. Например, электронная конфигурация кислорода (O) равна 1s^2 2s^2 2p^4, что означает, что на первом энергетическом уровне находятся 2 электрона, на втором энергетическом уровне – 2 электрона, а на третьем энергетическом уровне – 4 электрона.
Распределение электронов в атоме имеет важное значение для определения химических свойств элементов и их реакционной активности. Электроны на внешнем энергетическом уровне, называемом валентной оболочкой, определяют основные химические свойства элемента и его способность образовывать химические связи.
Итак, электроны играют основную роль в химии, определяя свойства элементов и их реакционную активность. Понимание их распределения в атоме позволяет описать валентные возможности атома и предсказывать его химическое поведение.
Энергетические уровни атома: что это такое и как они связаны
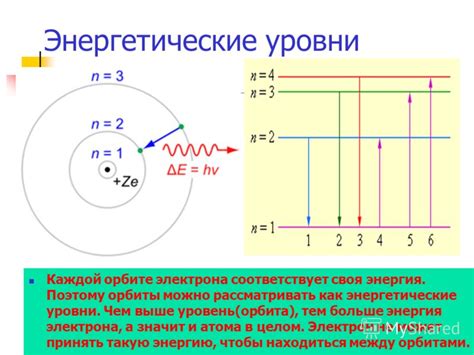
Энергетические уровни атома определяются электронной структурой атома, то есть распределением электронов по его оболочкам. Каждый электрон обладает определенным количеством энергии, которое зависит от его орбитальной энергии и момента импульса.
Энергетические уровни атома связаны с понятием квантования энергии. Каждый энергетический уровень имеет определенное значение энергии, которое является квантом энергии. Переход электрона с одного энергетического уровня на другой сопровождается поглощением или испусканием энергии в виде фотонов. Это объясняет явление спектральных линий, которые наблюдаются при изучении спектров атомов.
Энергетические уровни атома могут быть представлены в виде энергетической диаграммы, где более низкие уровни находятся ближе к ядру атома, а более высокие - дальше от ядра. Расстояние между уровнями определяется разницей в энергии.
Изучение энергетических уровней атома позволяет понять его спектральные свойства, взаимодействия с электромагнитным излучением и различные квантовые процессы, такие как фотоэффект и люминесценция. Также, понимание этих уровней позволяет разрабатывать новые технологии, связанные с использованием света и энергии, в том числе в фотонике и оптике.
Валентные электроны: что они означают и почему они важны
Количество валентных электронов для каждого элемента можно определить из его положения в таблице химических элементов Менделеева. Наиболее внешний энергетический уровень атома может содержать до 8 электронов, хотя есть и исключения. Например, у водорода на внешнем энергетическом уровне всего один электрон, а у гелия - два.
Валентные электроны играют важную роль в химических реакциях. Когда атомы образуют молекулы, они обмениваются своими валентными электронами, чтобы достичь стабильного электронного строения. Атомы стремятся заполнить свой внешний энергетический уровень максимально возможным числом электронов, что делает их более устойчивыми.
Валентные электроны также определяют химическую реактивность элементов. Элементы с неполным внешним энергетическим уровнем, то есть со свободными валентными электронами, имеют тенденцию образовывать химические связи с другими элементами, чтобы достичь стабильного состояния. Элементы с полностью заполненным внешним энергетическим уровнем, такие как инертные газы, обладают низкой химической активностью, поскольку у них отсутствуют свободные валентные электроны.
Понимание валентных электронов позволяет предсказывать молекулярные и кристаллические структуры, а также свойства и поведение химических соединений. Это важное понятие в химии, которое помогает объяснить многочисленные явления и реакции в мире вещества.
Валентная оболочка: её структура и свойства
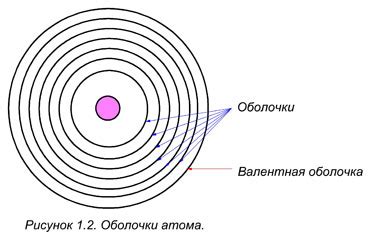
Внутренняя электронная оболочка (ядерная оболочка) представляет собой область пространства вокруг атомного ядра, где находятся электроны, не участвующие в химических связях. В то время как внутренняя оболочка заполняется по определенным энергетическим уровням, валентная оболочка может содержать наборы электронов, называемые электронными подуровнями.
Количество электронных подуровней в валентной оболочке зависит от числа электронов в этой оболочке. Электроны в каждом подуровне могут иметь определенный спин и орбитальный момент. Орбитальный момент определяет форму орбитали, на которой находится электрон.
Свойства валентной оболочки определяют химическую активность атома. За счет электронов в валентной оболочке атом может участвовать в образовании химических связей с другими атомами. Число электронов в валентной оболочке также определяет валентность атома, то есть число связей, которые он может образовать с другими атомами.
Изменение числа электронов в валентной оболочке может приводить к образованию ионов с положительным или отрицательным зарядом. При образовании ионов электроны могут быть переданы или приняты другим атомом, чтобы достичь более стабильной электронной конфигурации.
Ионизация атома: что это такое и как она происходит
Возможность ионизации зависит от внутренней структуры атома, в частности от энергетических уровней и распределения электронов. Если внешняя энергия, предоставляемая внешним фактором, превышает энергию удержания электрона в атоме, то электрон может быть оторван и атом становится положительно заряженным ионом.
Ионизация может происходить как одноэлектронно, когда у атома отрывается только один электрон, так и многоеэлектронно, когда отрывается несколько электронов одновременно. Количество отрывающихся электронов может зависеть от энергии внешнего фактора и от внутренних характеристик атома.
Ионизация атома является важной химической реакцией, так как образовавшиеся ионы обладают свойствами иного элемента и могут быть вовлечены в различные химические процессы. Этот процесс также имеет широкое применение в различных областях науки и технологии, например в спектроскопии, масс-спектрометрии и ядерной физике.
Химическая связь: как валентные электроны взаимодействуют друг с другом

Валентные электроны взаимодействуют друг с другом через обмен и деление электронов. Когда два атома приближаются друг к другу, их валентные электроны могут образовать связь, образуя новое общее энергетическое состояние - молекулу. Часто молекула образуется путем обмена пары электронов между атомами или путем деления одной или нескольких пар электронов.
Обмен электронами может происходить через образование лигандных связей. Лигандный связывает один атом с другим, когда атом делит одну из его валентных электронных пар с атомом другого элемента. Это позволяет образовывать межатомные связи и создавать структуры типа молекулы.
Деление электронной пары происходит при образовании ковалентной связи. Ковалентная связь возникает, когда два атома делят одну или несколько пар валентных электронов. При этом валентные электроны образуют общую область, называемую электронной оболочкой, которая содержит общие электроны и обеспечивает связь атомов в молекуле.
Валентные электроны взаимодействуют друг с другом, чтобы образовать стабильные химические соединения и обеспечить устойчивость атомов. Взаимодействие валентных электронов определяет свойства соединения и его химическую активность.
Валентные электроны электронной оболочки атома могут быть представлены в форме электронных пар или электронных облаков. Эти электронные области определяют пространственное распределение электронов и могут быть использованы для представления химической структуры атомов и молекул.
Валентность атома: понятие и его значение для реакций
Валентность атома играет важную роль в химических реакциях. Это определяет, сколько атомов других элементов может соединиться с данным атомом. Например, атом кислорода имеет валентность 2, поэтому он может образовывать две ковалентные связи с другими атомами. Атомы с разной валентностью будут иметь разные реакционные возможности и химические свойства.
Валентность атома может быть положительной или отрицательной. Положительная валентность обозначает, что атом имеет склонность к потере электронов, образуя положительный ион. Отрицательная валентность указывает на склонность атома к получению электронов, образуя отрицательный ион.
Знание валентности атомов помогает предсказывать, какие химические реакции могут происходить между различными веществами. Например, зная валентность атомов, можно предсказать, какие ионы будут образовываться в реакции и какие химические связи будут образовываться или разрушаться.
Сумма валентностей атомов в химическом соединении должна быть равна нулю, так как положительная валентность атомов должна быть скомпенсирована отрицательной валентностью. Это позволяет сохранить электрическую нейтральность соединения.
Валентность атома - важное понятие в химии, которое помогает понять и предсказать химические реакции и свойства веществ. Знание валентности атомов позволяет лучше понять молекулярную структуру веществ и их химические связи, играя ключевую роль в изучении химии и разработке новых соединений и материалов.
Валентные возможности атома: примеры и практическое применение

Валентные возможности атома представляют собой его способность образовывать химические связи с другими атомами для образования молекул. Это явление играет важную роль в химических реакциях и процессах, определяя свойства веществ.
Примеры валентных возможностей атома можно наблюдать во многих химических соединениях:
- Водород (H): один атом водорода может образовывать одну валентную связь с другим атомом, например, с атомом кислорода в воде (H2O).
- Кислород (O): атом кислорода может образовывать две валентные связи с другими атомами, например, с атомами водорода в молекуле воды (H2O).
- Углерод (C): атом углерода обладает четырьмя валентными связями, что позволяет ему образовывать различные молекулы, такие как метан (CH4).
- Азот (N): атом азота может образовывать три валентные связи, например, в молекуле аммиака (NH3).
- Фтор (F): атом фтора может образовывать одну валентную связь, например, в молекуле фторида натрия (NaF).
Практическое применение валентных возможностей атома простирается на различные области, включая фармацевтику, материаловедение и энергетику.
Например, изучение валентных связей атомов при разработке новых лекарств позволяет улучшить их эффективность и безопасность. Также, понимание валентных возможностей атомов помогает ученым разрабатывать новые материалы с определенными свойствами, такие как прочность или электропроводность. В области энергетики, исследования валентных связей атомов помогают разработать новые материалы для эффективного хранения и использования энергии.
Изучение и понимание валентных возможностей атома имеет огромное значение в химии и науке в целом, и продолжает играть ключевую роль в развитии новых технологий и открытии новых возможностей в различных областях науки и промышленности.








