Электроотрицательность - это физическая характеристика химического элемента, определяющая его способность притягивать электроны в химической связи. Электроотрицательность является важным показателем, который используется для определения химической активности элементов и свойств веществ. Однако, существуют факторы, влияющие на снижение электроотрицательности элементов.
Одной из причин снижения электроотрицательности является увеличение атомного радиуса элемента. Чем больше атомный радиус, тем дальше находятся электроны от ядра атома и слабее взаимодействуют с другими атомами. Это приводит к снижению электроотрицательности и возможности образования слабых химических связей.
Кроме того, отталкивающие электростатические силы между электронами на внешней оболочке также могут влиять на снижение электроотрицательности элементов. Если на внешней оболочке находится много электронов, они начинают отталкиваться друг от друга, создавая сильные отталкивающие силы. Это может снижать электроотрицательность элемента, так как электроны наоборот проявляют меньшую способность привлекать других электроны в химической связи.
Электроотрицательность - это важный параметр химических элементов, который влияет на их химические свойства и возможность образования химических связей в веществах. Различные факторы, такие как атомный радиус и внешняя электронная структура, могут оказывать влияние на снижение электроотрицательности элементов. Понимание этих факторов помогает лучше понять химическую природу веществ, их реакционную способность и связанное с этим поведение.
Уровень электроотрицательности и его изменения
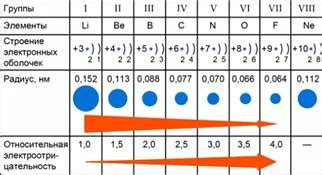
Уровень электроотрицательности может изменяться как в периоде, так и в группе таблицы Менделеева. По мере движения по периоду, электроотрицательность элементов обычно увеличивается. Это связано с увеличением количества протонов в атомном ядре, что приводит к сильному притяжению электронов.
В группе элементы имеют одинаковое количество электронных оболочек, поэтому обычно имеют близкие значения электроотрицательности. Однако, уровень электроотрицательности может изменяться внутри группы из-за различий в электронной конфигурации. Например, в группе переходных металлов, электроотрицательность увеличивается со снижением радиуса атомов.
Изменение электроотрицательности влияет на химические связи. При образовании ковалентных связей, электроотрицательность атомов определяет положение электронов в молекуле. Если разница в электроотрицательности атомов вещества большая, то электроны будут притягиваться сильно к одному атому, что приведет к поляризации связи.
Поляризованная связь обладает характерными свойствами, например, водородные связи. Кроме того, разница в электроотрицательности помогает определить тип химической связи – ионную или ковалентную. Чем больше разница в электроотрицательности, тем вероятнее образование ионной связи, где электроны переходят от одного атома к другому.
Факторы, влияющие на снижение электроотрицательности
Электроотрицательность элемента определяет его способность притягивать электроны в химической связи. Однако, существуют определенные факторы, которые могут снижать электроотрицательность элемента.
- Размер атома: С увеличением размера атома электроотрицательность обычно снижается. Большие атомы имеют более дальнее расположение электронов от ядра, что снижает взаимное притяжение их с другими атомами.
- Экранирование электронной оболочки: Наличие внутренних электронов может экранировать внешние электроны от притяжения ядра. Это приводит к снижению электроотрицательности элемента.
- Частота распределения электронов: Если оболочка атома полностью заполнена или имеет полуполную или полупустую электронную конфигурацию, то электроотрицательность может быть ниже. Это связано с более стабильными состояниями атома.
- Химическая структура: Химические связи и геометрия молекул также могут влиять на электроотрицательность элементов. Например, сопряженные системы электронных облаков в органических молекулах могут снижать электроотрицательность атомов, находящихся внутри таких систем.
Все эти факторы взаимодействуют и могут влиять на электроотрицательность элементов, образуя более или менее полярные химические связи.
Влияние снижения электроотрицательности на химические связи
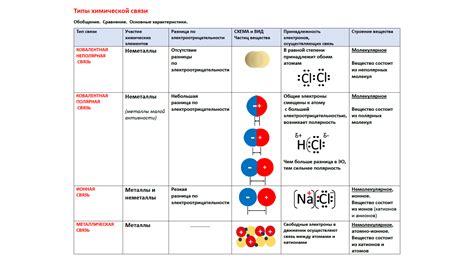
Электроотрицательность элемента определяет его способность притягивать электроны в химической связи. Чем выше электроотрицательность, тем сильнее элемент притягивает электроны. Снижение электроотрицательности влияет на химические связи в следующих аспектах:
1. Полярность связи: Если электроотрицательность одного из элементов, образующих связь, снижается, то эта связь становится менее полярной. Полярность связи химических элементов определяет разность их электроотрицательностей. Более низкая полярность связи может снизить химическую активность соединения и повлиять на его химические и физические свойства.
2. Силы притяжения: Снижение электроотрицательности элемента приводит к снижению сил притяжения в химической связи и более слабым взаимодействиям между атомами. Это может сказаться на химической реактивности соединения и способности к образованию и разрыву связей.
3. Реакционная способность: Электроотрицательность влияет на реакционную способность элементов. Снижение электроотрицательности может привести к изменению химической активности элемента и его способности участвовать в химических реакциях.
4. Тип связи: Электроотрицательность элементов может определять тип химической связи. Снижение электроотрицательности может влиять на тип связи и взаимодействие атомов.
В целом, снижение электроотрицательности влияет на химические связи путем изменения полярности, силы притяжения, реакционной способности и типа связи между элементами. Это имеет важное значение при изучении и понимании химических соединений и их свойств.
Практическое применение снижения электроотрицательности
Снижение электроотрицательности может иметь ряд практических применений и значительное влияние на свойства и химические связи веществ.
Одним из практических примеров является применение материалов с низкой электроотрицательностью в электронике. Такие материалы, например, металлы, обладающие низкой электроотрицательностью, хорошо проводят электрический ток и обладают высокой электрической проводимостью. Они также могут быть устойчивыми к окислению и коррозии.
Снижение электроотрицательности также может приводить к образованию ионных связей при взаимодействии атомов с разных концов таблицы Менделеева. Это имеет важное практическое применение в области синтеза и получения различных соединений. Например, вода (H2O) образуется путем образования ионных связей между атомами водорода (H) и атомом кислорода (O).
Кроме того, снижение электроотрицательности может способствовать образованию ковалентных связей между атомами, например, в органических соединениях. Ковалентные связи позволяют молекулам соединяться в сложные структуры и обладать определенными свойствами. Например, углерод, обладающий низкой электроотрицательностью, может образовывать ковалентные связи с другими атомами углерода и различными элементами, что позволяет создавать широкий спектр органических соединений.
Таким образом, снижение электроотрицательности играет важную роль в определении свойств и химических связей веществ. Это открывает широкие возможности для разработки новых материалов, соединений и технологий в различных отраслях промышленности и науки.








