Оксиды являются важным классом неорганических соединений, которые образуются при реакции металлов или неметаллов с кислородом. Они могут быть кислотными, основными или амфотерными, что зависит от их химического состава и свойств.
Кислотные оксиды, или оксиды неметаллов, обычно образуются при реакции неметалла с кислородом, их химическая формула может быть записана в виде MOn. Кислотные оксиды обладают кислотными свойствами и взаимодействуют с водой, образуя кислоты.
Основные оксиды, или оксиды металлов, образуются в результате реакции металла с кислородом, их химическая формула может быть записана в виде M2On. Они обладают щелочными свойствами и реагируют с водой, образуя гидроксиды металлов.
Некоторые оксиды обладают амфотерными свойствами, что означает, что они могут взаимодействовать как с кислотами, так и со щелочами. Примером такого оксида является оксид алюминия (Al2O3), который может реагировать как с кислотами, так и с щелочами, образуя алюминиевые соли или гидроксид алюминия.
Основные моменты указания характера оксида
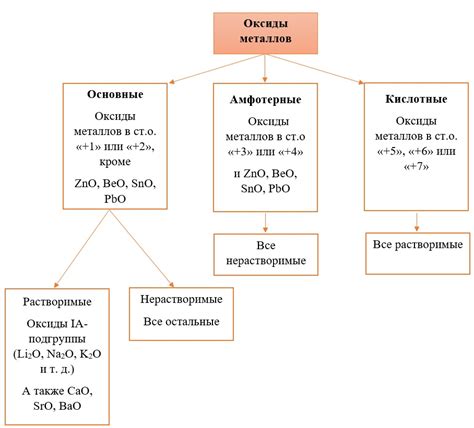
Характер оксида указывает на его реакционную способность и свойства. В зависимости от типа химической связи, тип оксида может быть кислотным, основным, амфотерным или нейтральным.
Кислотный оксид образуется при соединении металла с кислородом. Он обладает кислотными свойствами, реагирует с водой, образуя кислоты. Примером кислотного оксида является углекислый газ (СО2).
Основным оксидом называется соединение неметалла с кислородом. Он образует щелочные растворы воды, обладает щелочными свойствами. Примером основного оксида является оксид кальция (CaO).
Амфотерные оксиды могут проявлять как кислотные, так и щелочные свойства. Они реагируют как с кислотами, так и с щелочами. В качестве примера амфотерного оксида можно привести оксид алюминия (Al2O3).
Нейтральный оксид не образует ни кислот, ни оснований. Он не реагирует с водой и не изменяет ее кислотно-щелочной реакции. Примером нейтрального оксида является оксид магния (MgO).
Оксид элемента: что это такое?
Оксид элемента представляет собой химическое соединение, состоящее из атомов самого элемента и кислорода. Этот тип соединения образуется при реакции металлов или неметаллов с кислородом. Оксиды элементов имеют важное значение во многих областях науки и техники.
Строение оксидов
Оксиды элементов могут быть двух типов - кислотные и основные. Кислотные оксиды образуются при сочетании кислорода с неметаллами, а основные - с металлами. Строение оксидов также может быть различным. Например, некоторые оксиды имеют ионную структуру, где атомы кислорода связаны с атомами элемента посредством ионных связей. Другие оксиды могут иметь ковалентную структуру, где атомы элемента и кислорода связаны посредством ковалентных связей.
Важно отметить, что оксид элемента может обладать различными свойствами в зависимости от характера элемента и его степени окисления. Например, некоторые оксиды могут обладать кислотными свойствами, способностью реагировать с основаниями и образовывать соли.
Применение оксидов
Оксиды элементов имеют широкий спектр применений. Они используются в производстве различных материалов, в технологии электролитического синтеза, в качестве катализаторов химических реакций, а также в медицине и различных отраслях науки.
Как указывать характер оксида?
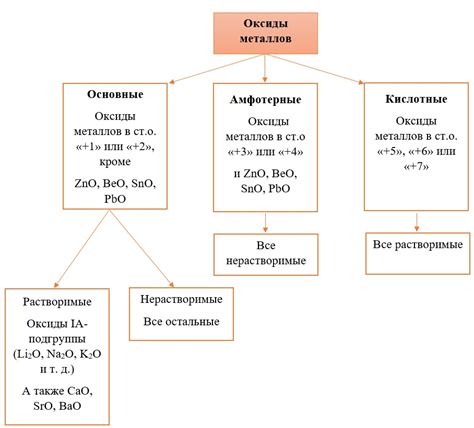
Характер оксида зависит от состава и свойств соединяемых элементов. Он может быть кислотным, основным, амфотерным или нейтральным.
Кислотный оксид образуется при соединении кислорода с неметаллами. Он обладает кислотными свойствами и может образовывать кислотные растворы. Примеры кислотных оксидов: оксид серы, оксид азота, оксид углерода.
Основный оксид образуется при соединении кислорода с металлами. Он обладает основными свойствами и может образовывать основные растворы. Примеры основных оксидов: оксид натрия, оксид кальция, оксид магния.
Амфотерный оксид обладает как кислотными, так и основными свойствами. Он может реагировать как с кислотами, так и с основаниями. Примеры амфотерных оксидов: оксид алюминия, оксид цинка, оксид железа.
Нейтральный оксид не реагирует с кислотами или основаниями и не обладает кислотно-основными свойствами. Примеры нейтральных оксидов: оксид гелия, оксид неона, оксид криптона.
Определение характера оксида является важным в химии, так как это позволяет понять его свойства и способность взаимодействовать с другими веществами.
Роль оксидов в химических реакциях
Во-первых, оксиды часто выступают как реакционные агенты. Например, многие оксиды металлов (как Fe2O3, CuO и Mn2O3) могут реагировать с кислородом, образуя соответствующие оксиды металлов. Эти реакции позволяют получать металлы из их руд и имеют большое промышленное значение.
Во-вторых, многие оксиды обладают кислотными или щелочными свойствами и могут реагировать с кислотами или основаниями, образуя соли. Например, SiO2 реагирует с гидроксидом натрия (NaOH) и образует натриевый силикат. Эти реакции выполняют важную роль в стекольной и керамической промышленности, а также в производстве жидкого стекла.
Кроме того, оксиды могут служить катализаторами во многих химических реакциях. Например, оксиды металлов, такие как оксид железа (Fe2O3), часто используются в промышленности для катализа важных процессов, таких как окисление аммиака для производства азотной кислоты.
Таким образом, оксиды играют важную роль в химических реакциях и широко применяются в различных отраслях промышленности. Изучение их свойств и взаимодействий является неотъемлемой частью химического образования и исследований в области материаловедения.








