Атом – это основная частица, из которой состоит вся материя в мире. Схема строения атома является ключевым концептом в молекулярной физике и химии. Она помогает нам понять, какие частицы составляют атом и как они взаимодействуют между собой. Схема строения атома основывается на атомной теории.
Атомная теория – это научная концепция, предполагающая, что все вещества состоят из мельчайших неделимых частиц – атомов. Атомы имеют ядро, в котором содержится протоны и нейтроны, а также электроны, движущиеся по определенным орбитам вокруг ядра. Каждый атом имеет уникальное количество протонов в ядре, которое определяет его химические свойства и положение в периодической таблице элементов.
Как правило, схема строения атома представляется в виде диаграммы, которая включает в себя схему ядра и расположение электронов на энергетических уровнях. Для лучшего понимания масштабов атомов, можно привести аналогию с солнечной системой: ядро атома – это Солнце, вокруг которого вращаются электроны, похожие на планеты.
Схема строения атома позволяет объяснить такие понятия, как атомные числа, массовое число, изотопы, ионы и другие ключевые принципы молекулярной физики и химии. Благодаря этой схеме мы можем понять, почему разные элементы обладают разными свойствами и как они сочетаются друг с другом, образуя молекулы и соединения.
Что такое схема строения атома?
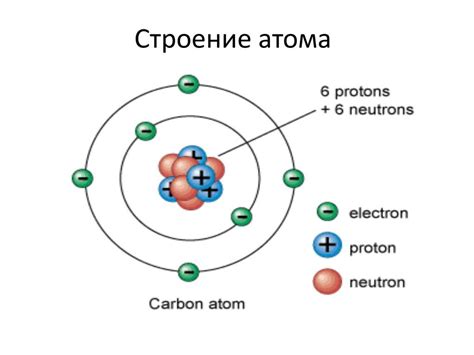
Атом, как минимальная единица вещества, состоит из ядра и электронной оболочки. Ядро содержит протоны и нейтроны, а электронная оболочка – электроны. Схема строения атома помогает наглядно представить это устройство и расположение электронов на различных энергетических уровнях, также известных как электронные оболочки.
На схеме строения атома электронные оболочки обычно изображаются в виде энергетических уровней, расположенных по кругу вокруг ядра. Ближайший к ядру уровень называется первой оболочкой и может содержать не более 2 электронов. Вторая оболочка может содержать до 8 электронов. Следующие оболочки также могут содержать до 8 электронов.
Схема строения атома помогает лучше понять количество и расположение электронов, а также их взаимодействие с ядром и друг с другом. Это позволяет объяснить такие явления, как химическая связь, атомные и молекулярные спектры, а также различные реакции и свойства веществ. Кроме того, схема строения атома играет важную роль в изучении элементов и их распределении в таблице Менделеева.
Основные понятия и принципы
Ядро атома содержит положительно заряженные частицы - протоны и нейтроны. Протоны имеют положительный заряд и определяют атомный номер, а нейтроны не имеют заряда и отвечают за атомную массу.
Электроны - это отрицательно заряженные частицы, которые движутся вокруг ядра по определенным энергетическим уровням или орбитам.
Орбитали - это трехмерные области пространства, где наиболее вероятно обнаружить электрон. Они характеризуются своей формой и энергетическим уровнем.
Энергетические уровни - это дискретные значения энергии, на которых могут находиться электроны. Чем ближе энергетический уровень к ядру, тем меньше энергии имеет электрон. Уровни разделены на подуровни, которые характеризуют количество и форму орбиталей.
Электронные конфигурации описывают распределение электронов по энергетическим уровням и подуровням. Электроны в атоме стремятся занять наименее энергетически затратные орбитали.
Диаграмма Мёллера - это удобная графическая схема, на которой показывается распределение электронов по энергетическим уровням и подуровням.
Принцип полного заполнения заключается в том, что электроны заполняют доступные орбитали с наименьшей энергией в порядке возрастания энергетических уровней и с соблюдением правила Паули и правила Гунда.
Правило Паули гласит, что в одной орбитали может находиться не более двух электронов, причем они должны иметь противоположные спины.
Правило Гунда гласит, что электроны заполняют орбитали одного подуровня по одному с противоположными спинами, прежде чем начать заполнять орбитали следующего подуровня.
Строение атома: атомные частицы и их роль
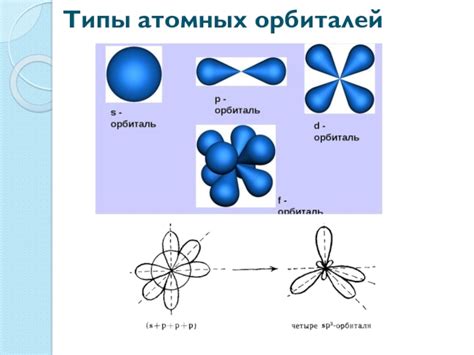
Протоны имеют положительный электрический заряд, в то время как нейтроны не имеют заряда. Протоны и нейтроны находятся в ядре атома, которое имеет положительный заряд, так как он содержит протоны. Количество протонов в ядре определяет химические свойства элемента и называется атомным числом.
Вокруг ядра атома находятся электроны, имеющие отрицательный заряд. Электроны движутся по орбитам или энергетическим уровням, которые определяются их энергией. Количество электронов в атоме равно количеству протонов, что делает атом электрически нейтральным.
Распределение электронов по энергетическим уровням происходит в соответствии с принципом заполнения электронных оболочек. Электроны заполняют оболочки от низшей к высшей энергетической.
Строение атома и распределение его частиц имеет существенное значение для понимания свойств и реактивности химических элементов, и служит основой для многих научных исследований и применений в различных областях науки и технологии.
Принципы орбитали и электронной оболочки
Принципы орбитали и электронной оболочки определяют порядок заполнения электронами. Основные принципы:
- Принцип заполнения электронной оболочки гласит, что орбитали заполняются по возрастанию их энергии. Согласно этому принципу, сначала заполняются орбитали меньшей энергии, а затем - орбитали с более высокой энергией.
- Принцип Паули устанавливает, что в каждой орбитали может находиться максимум два электрона, которые должны иметь противоположные по спину.
- Принцип устранения максимального возможного экранирования (принцип Хунда) предполагает, что электроны заполняют орбитали одного энергетического уровня по отдельности, перед тем как парные электроны будут размещены.
Эти принципы орбитали и электронной оболочки помогают понять, как происходит заполнение электронами атомных оболочек, а также объясняют химическую активность элементов.
Элементарные частицы и атомное ядро
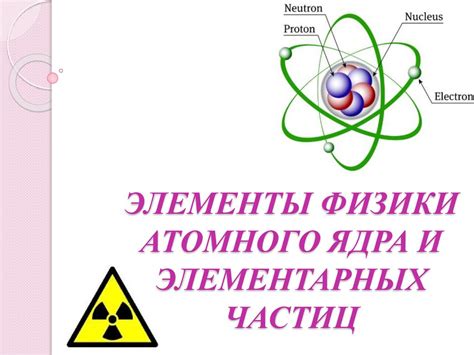
Атом состоит из элементарных частиц, включающих электроны, протоны и нейтроны. Три этих элементарных частицы составляют атомное ядро.
Электроны - отрицательно заряженные частицы, которые обращаются по орбитам вокруг ядра атома. Масса электрона очень мала по сравнению с массой протона и нейтрона, поэтому его массу можно пренебречь при рассмотрении остальных элементарных частиц.
Протоны - положительно заряженные частицы, находящиеся в ядре атома. Они имеют массу, превышающую массу электрона примерно в 1836 раз. Количество протонов в атоме определяет его атомный номер, который соответствует порядковому номеру элемента в периодической системе.
Нейтроны - нейтральные частицы, находящиеся в ядре атома. Они также имеют массу, превышающую массу электрона примерно в 1836 раз. Нейтроны не имеют заряда, поэтому их количество в атоме не имеет отношения к его химическим свойствам, а служит для стабилизации ядра.
Атомное ядро представляет собой компактное образование, содержащее протоны и нейтроны. Протоны обеспечивают положительный заряд ядра и определяют его атомный номер. Нейтроны сохраняют стабильность ядра и его массу. Массовое число атомного ядра определяется суммой количества протонов и нейтронов.
| Элементарная частица | Заряд | Масса |
|---|---|---|
| Электрон | Отрицательный | Очень малая |
| Протон | Положительный | Относительно большая |
| Нейтрон | Нейтральный | Относительно большая |
Распределение электронов по оболочкам
Атом состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, которое образует оболочки. Оболочки представляют собой энергетические уровни, на которых находятся электроны.
Распределение электронов по оболочкам определяется принципами заполнения электронных оболочек:
- Принцип наименьшей энергии: электроны заполняют оболочки с наименьшей энергией первыми.
- Принцип заполнения по принципу Паули: на каждом энергетическом уровне может находиться не более двух электронов с противоположным спином.
- Принцип Гунда: при заполнении оболочек на первых энергетических уровнях сначала заполняются все s-орбитали, затем p-, d- и f-орбитали.
Обозначение электронных оболочек происходит с помощью английских букв: K, L, M, N и т.д. Каждая оболочка может содержать определенное количество электронов:
- Оболочка K: может содержать до 2 электронов
- Оболочка L: может содержать до 8 электронов
- Оболочка M: может содержать до 18 электронов
- Оболочка N: может содержать до 32 электронов
- и т.д.
Распределение электронов по оболочкам имеет важное значение для определения химических свойств атома и его позиции в периодической системе элементов.
Энергетические уровни и квантовые числа

В атоме энергетические уровни обозначаются квантовыми числами. Квантовые числа описывают состояние и положение электронов в атоме.
Основные квантовые числа:
- Главное квантовое число (n) определяет главный энергетический уровень. Оно может принимать целочисленные значения от 1 до бесконечности.
- Орбитальное квантовое число (l) определяет форму орбитали и момент импульса электрона. Оно может принимать значения от 0 до (n-1).
- Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l.
Дополнительное квантовое число, селекционное (спиновое) квантовое число (s), определяет спин электрона и может принимать значения +1/2 или -1/2.
Комбинации квантовых чисел определяют электронную конфигурацию атома, то есть распределение электронов по энергетическим уровням и подуровням.
Электронные конфигурации и периодическая система элементов
Электронные конфигурации атомов описывают расположение электронов в оболочках и подобластях атома. Каждая электронная конфигурация состоит из серии чисел и букв, представляющих различные уровни энергии и подуровни.
Периодическая система элементов позволяет упорядочить и классифицировать химические элементы в соответствии с их атомными свойствами. В основе периодической системы лежит таблица Менделеева, где элементы расположены в порядке возрастания атомного номера.
Каждый элемент в периодической системе имеет свою атомную структуру, которая определяется его электронной конфигурацией. Электронные конфигурации помогают предсказать свойства и поведение химических элементов, так как они определяют количество и расположение электронов в атоме.
Атомная структура и электронные конфигурации элементов помогают разобраться в химической реактивности, а также объясняют множество химических свойств и закономерностей, наблюдаемых в периодической системе. Они также играют важную роль в понимании процессов образования химических связей и молекул.
Электронные конфигурации и периодическая система элементов являются основополагающими понятиями в химии и необходимы для работы во всех ее областях, от органической и неорганической химии до физической и аналитической.
Влияние схемы строения атома на химические свойства

Схема строения атома имеет огромное влияние на его химические свойства. Понимание схемы строения атома позволяет установить, какие элементы обладают схожими свойствами и как они будут взаимодействовать друг с другом.
Один из основных аспектов, который определяет химические свойства атома, - это его электронная конфигурация. Электронная конфигурация определяет, какие электроны находятся на внешней оболочке атома, а также какие они имеют энергетические уровни.
Атомы, у которых внешняя оболочка имеет одно и то же количество электронов, принадлежат к одной группе в таблице Менделеева и имеют схожие химические свойства. Между элементами одной группы происходят подобные реакции, так как они имеют одну и ту же валентность и стремятся завершить свою внешнюю оболочку, чтобы достичь стабильности.
Также, электронная конфигурация атома влияет на его способность образовывать соединения. Атомы с несколькими электронами на внешней оболочке могут образовывать связи с другими атомами, обменяя или делая общими их электроны, чтобы достичь стабильного состояния. Чем больше электронов на внешней оболочке, тем больше атом может образовывать связей и тем более сложные соединения он может образовывать.
Таким образом, схема строения атома позволяет определить его химические свойства и предсказывать, какие взаимодействия могут происходить между атомами. Это является основой для понимания и изучения химических реакций и образования различных соединений.
Роль схемы строения атома в физических процессах
Схема строения атома основывается на модели атома, разработанной в научных исследованиях. Она включает в себя такие понятия, как ядро атома, состоящее из протонов и нейтронов, а также электроны, движущиеся вокруг ядра по энергетическим уровням.
С помощью схемы строения атома можно объяснить множество физических процессов. Например, процесс ионизации, при котором атом теряет или приобретает электроны, может быть объяснен на основе перемещения электронов между энергетическими уровнями.
Другой важный физический процесс, который можно объяснить с помощью схемы строения атома, – это взаимодействие атомов между собой. Если атомы вступают в химическую реакцию, они обмениваются электронами, что может быть представлено с помощью схемы строения атома.
Кроме того, схема строения атома помогает в изучении явлений, связанных с радиоактивностью. Например, в процессе альфа-распада ядро атома испускает частицу альфа, что может быть представлено на схеме строения атома.
Все эти примеры демонстрируют, что схема строения атома является незаменимым инструментом в физических исследованиях. Она позволяет наглядно представить и объяснить различные физические процессы, происходящие на атомном уровне.








