Полярность молекулы является важным понятием в химии. Она описывает разность в электроотрицательности атомов в молекуле и распределение электронной оболочки. Когда атомы различаются по электроотрицательности, возникают частичные положительные и отрицательные заряды, что делает молекулу полярной.
Полярные молекулы характеризуются наличием диполя - разделения положительного и отрицательного зарядов. При этом, внешняя часть молекулы имеет отрицательный заряд, а внутренняя – положительный. Это приводит к появлению межмолекулярных сил притяжения, называемых межмолекулярными взаимодействиями.
Полярность молекулы оказывает существенное влияние на химические свойства вещества. Она определяет способность молекулы принимать и передавать электроны, а также её растворимость в различных растворителях.
Молекулы с высокой полярностью обладают большей растворимостью в полярных растворителях, таких как вода. Это связано с тем, что полярные растворители способны взаимодействовать с полярными молекулами за счет сил притяжения между зарядами разного знака.
С другой стороны, неполярные молекулы обладают незначительной полярностью и не притягивают другие молекулы с такой же силой, как полярные. Из-за этого они легко растворяются в неполярных растворителях, например, веществах на нефтяной основе.
Полярность молекулы: важные аспекты
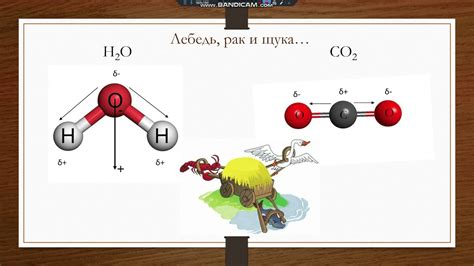
Полярность молекулы играет важную роль в химических свойствах вещества. Она может влиять на растворимость вещества в различных средах, точку кипения и плавления, а также на его химическую реактивность.
Влияние полярности на растворимость связано с тем, что полярные молекулы имеют способность образовывать взаимодействия с другими полярными молекулами или ионами. Например, полярные молекулы воды могут образовывать водородные связи с другими полярными молекулами, что способствует их растворению в воде.
Полярность также влияет на точку кипения и плавления вещества. Полярные вещества обычно имеют более высокую точку кипения и плавления, так как для разрыва сил взаимодействия между полярными молекулами требуется больше энергии.
Химическая реактивность вещества также может зависеть от его полярности. Полярные молекулы могут взаимодействовать с другими полярными молекулами или ионами с большей легкостью, что способствует возникновению различных химических реакций и превращениям вещества.
Важно отметить, что полярность молекулы может быть определена на основе разности электроотрицательностей атомов, из которых она состоит. Если электроотрицательности атомов различны, то молекула будет полярной с направленным дипольным моментом. Если электроотрицательности атомов одинаковы или очень близки по величине, молекула будет неполярной.
Что такое полярность молекулы?
Полярность возникает из-за неравномерного распределения электронной плотности в пределах молекулы. Это происходит, когда электроотрицательность атомов, составляющих молекулу, неодинакова. Атомы с более высокой электроотрицательностью притягивают электроны сильнее и образуют область с отрицательным зарядом, тогда как атомы с более низкой электроотрицательностью образуют область с положительным зарядом.
Полярность молекулы оказывает существенное влияние на ее химические свойства. Она может влиять на растворимость молекулы в разных средах, на ее точку кипения и точку плавления, а также на способность молекулы образовывать водородные связи или межмолекулярные взаимодействия.
Для определения полярности молекулы необходимо учитывать электроотрицательности атомов в ней, а также их геометрическое расположение. В зависимости от этих факторов, молекула может быть полностью полярной, неполярной или иметь частичную полярность.
Таблица ниже иллюстрирует примеры полностью полярных и неполярных молекул:
| Молекула | Полярная / Неполярная |
|---|---|
| Вода (H2O) | Полярная |
| Метан (CH4) | Неполярная |
| Диоксид углерода (CO2) | Неполярная |
| Аммиак (NH3) | Полярная |
Как определяется полярность молекулы?
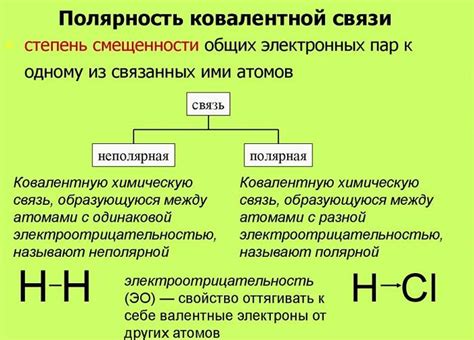
Полярность молекулы определяется разностью электроотрицательностей атомов, составляющих молекулу, и их геометрическим расположением.
Если атомы в молекуле имеют одинаковую электроотрицательность, то молекула является неполярной. В этом случае электронная плотность равномерно распределена между атомами и не создает дипольного момента, который отвечает за полярность молекулы. Примером неполярной молекулы может служить молекула кислорода (O2).
Если атомы в молекуле обладают разной электроотрицательностью, то молекула является полярной. В этом случае электронная плотность смещается ближе к атому с более высокой электроотрицательностью, что создает разделение зарядов и возникает дипольный момент. Примером полярной молекулы может служить молекула воды (H2O).
Полярность молекулы может влиять на ее химические свойства. Полярные молекулы могут образовывать водородные связи, что делает их более устойчивыми и имеющими более высокие температуры кипения и плавления. Также полярные молекулы обладают хорошей растворимостью в полярных растворителях, а неполярные молекулы - в неполярных растворителях.
Роль полярности молекулы в химических свойствах
Когда молекула является полярной, она имеет неравномерное распределение зарядов. В результате, полярные молекулы могут образовывать диполи, где одна часть молекулы заряжена положительно, а другая - отрицательно. Данный дипольный характер молекулы придает ей ряд свойств.
Во-первых, полярные молекулы способны образовывать водородные связи. Водородные связи возникают между атомом водорода положительно заряженного атома водородной связи и атомом другой молекулы. Это приводит к образованию сильных и стабильных связей между молекулами, что может привести к повышенной температуре кипения и объясняет высокую плотность воды.
Во-вторых, полярные молекулы обладают свойством растворимости. Полярные молекулы могут легко растворяться в других полярных растворителях, так как притягиваются к полярным молекулам этого растворителя. Напротив, неполярные молекулы имеют слабые межмолекулярные силы и образуют неполярные растворы.
Полярность также может влиять на реакционную способность молекулы. Например, полярные молекулы могут быть легче подвергаться электрофильному или нуклеофильному атакам в химических реакциях. Это связано с тем, что полярность создает разницу в электронной плотности и делает молекулу более подвижной и доступной для реакции.
Таким образом, полярность молекулы является важным аспектом, определяющим ее химические свойства. Она влияет на способность молекулы образовывать связи с другими молекулами, растворяться и участвовать в химических реакциях.
Полярность молекулы и ее взаимодействие с другими веществами
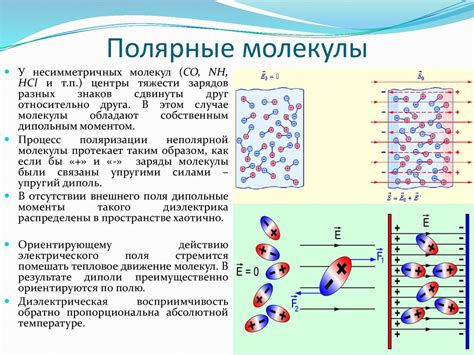
Полярные молекулы обладают неравномерным распределением электронной плотности, что приводит к появлению диполя. Такие молекулы могут взаимодействовать друг с другом и с другими веществами с помощью таких сил, как дисперсионные, диполь-дипольные и водородные связи.
Дисперсионные силы взаимодействия возникают даже в неполярных молекулах. Они обусловлены временным неравномерным распределением зарядов в молекуле, что приводит к появлению момента диполя и возникновению электростатического притяжения между молекулами.
Диполь-дипольные силы взаимодействия действуют между двумя полярными молекулами, имеющими постоянный дипольный момент. Они обусловлены притяжением положительно заряженной частицы одной молекулы к отрицательно заряженной частице другой молекулы.
Водородные связи являются особым типом диполь-дипольных связей и возникают между атомами водорода, связанными с атомами кислорода, азота или фтора. Эти связи обладают особо высокой энергией и способны образовывать стабильные комплексы между молекулами, что сказывается на химических и физических свойствах вещества.
Взаимодействие полярных молекул с неполярными молекулами также возможно, но оно обусловлено только дисперсионными силами. В таком случае возникают слабые взаимодействия, которые, тем не менее, могут быть значимыми при формировании структуры и свойств вещества.
Таким образом, полярность молекулы играет важную роль в химических свойствах вещества и его способности взаимодействовать с другими веществами. Различные типы взаимодействий, такие как дисперсионные силы, диполь-дипольные и водородные связи, обусловлены наличием полярности в молекулах и способствуют формированию структуры и свойств вещества.








