Степень окисления – это числовое значение, которое отражает электрохимическое состояние атома в химическом соединении. Окисление – процесс потери электронов атомом, а восстановление – процесс приобретения электронов атомом. Степень окисления помогает определить, какие ионы электронами обогащаются, а какие ионы электроны отдают.
Наиболее устойчивой степенью окисления называется то значение, при котором атом находится в своем наиболее стабильном электрохимическом состоянии. Это означает, что при достижении такой степени окисления атом с наименьшей вероятностью будет обменять электроны с другими атомами.
Существует несколько правил, которые помогают определить наиболее устойчивую степень окисления для различных элементов. Например, для кислорода (О) наиболее устойчивой степенью окисления является -2. Это связано с тем, что кислород имеет высокую электроотрицательность и обычно образует двойные или одинарные связи с другими элементами.
Степень окисления и его значение в химии

Знание степени окисления позволяет определить химическую активность вещества, его восстановительные или окислительные свойства, а также предсказать его химическое поведение в реакциях. Окислительные и восстановительные реакции являются основой многих важных процессов, таких как сжигание топлива, дыхание клеток и окисление пищи в организме.
Примеры веществ с разными степенями окисления включают йод в йодиде (I^-) со степенью окисления -1, йод в хлористом йоде (ICl) со степенью окисления +1, кислород в воде (H2O) со степенью окисления -2 и кислород в пероксиде водорода (H2O2) со степенью окисления -1.
Окислительно-восстановительные реакции: основные принципы
Принципы ОВР основаны на том, что при реакции происходит перераспределение электронов между реагентами. Один реагент отдает электроны, становясь окислителем, а другой реагент принимает электроны, становясь восстановителем.
Окислитель – это химическое вещество, способное отдавать электроны и при этом само получать положительный заряд. Восстановитель – это химическое вещество, способное принимать электроны и при этом само получать отрицательный заряд.
Реакция окисления-восстановления может быть показана в виде химического уравнения, где окислитель и восстановитель указываются соответствующим образом. Например, реакция между медным купоросом (окислитель) и цинком (восстановитель) может быть записана следующим образом:
- CuSO4 + Zn -> Cu + ZnSO4
В данной реакции цинк служит восстановителем, так как принимает электроны и окисляет медный купорос, который служит окислителем.
Окислительно-восстановительные реакции являются важными в природе и живых организмах. Например, это важный процесс в дыхании, где глюкоза окисляется в организме, чтобы получить энергию. ОВР также используются в электрохимических элементах, таких как батарейки и аккумуляторы.
Определение наиболее устойчивой степени окисления

Степень окисления химического элемента указывает на число электронов, которые он получает или отдаёт при образовании химических связей. Обозначается числом с знаком "+" или "-" перед элементным символом.
Определение наиболее устойчивой степени окисления важно для понимания реакций, свойств и поведения химических элементов. Знание наиболее устойчивых степеней окисления помогает предсказывать и объяснять образование соединений и химические реакции.
Примеры наиболее устойчивых степеней окисления включают +2 для кальция, +3 для алюминия, +4 для углерода, +1 для лития и -2 для кислорода.
Роль наиболее устойчивой степени окисления в химических реакциях
Наиболее устойчивая степень окисления определяется на основе электронной конфигурации атома. Она соответствует наиболее распространенному или типичному значению, которое элемент обычно принимает, а также где часть электронов находится в заполненных орбиталях, а часть - в незаполненных. Нормальные значения можно найти в таблицах степеней окисления и являются важными справочными данными для установления состава и свойств химических соединений.
Роль наиболее устойчивой степени окисления проявляется во многих аспектах химических реакций. Она может быть использована для определения окислителей и восстановителей в реакции окисления-восстановления. Например, элемент с более высокой степенью окисления обычно выступает в качестве окислителя, а элемент с более низкой степенью окисления - в качестве восстановителя.
Также наиболее устойчивая степень окисления позволяет определить тип связи, который образуется между элементами в химическом соединении. Например, металлы с высокими степенями окисления образуют ионные соединения, где электроны передаются от металла к неметаллу. А элементы с более низкими степенями окисления формируют ковалентные соединения, где электроны общие и образуют пары с обоих элементов.
Разница в наиболее устойчивых степенях окисления также способствует образованию разных оксидов и кислот. Например, металлы с разными степенями окисления образуют различные оксиды, где присутствуют разные комбинации атомов элемента с кислородом. Это оказывает влияние на свойства и реактивность соединений.
Таким образом, наиболее устойчивая степень окисления играет важную роль в определении химических свойств элементов и соединений, а также в понимании механизмов химических реакций.
Примеры наиболее устойчивой степени окисления
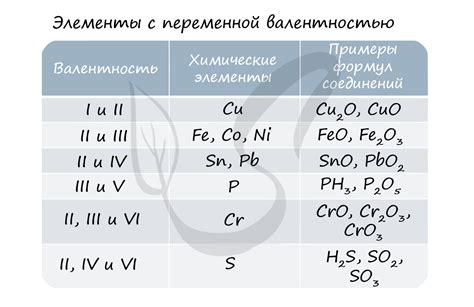
Примеры наиболее устойчивой степени окисления для некоторых химических элементов:
| Элемент | Наиболее устойчивая степень окисления |
|---|---|
| Водород (H) | +1 |
| Кислород (O) | -2 |
| Хлор (Cl) | -1 |
| Азот (N) | -3 |
| Железо (Fe) | +2, +3 |
Эти примеры демонстрируют наиболее устойчивые степени окисления для некоторых элементов, но существуют и другие степени окисления для данных элементов, которые могут быть также стабильными в определенных условиях.








