Катализатор – это вещество, которое способно ускорять химические реакции без изменения своей молекулярной структуры. Он играет важную роль в промышленности и нашей повседневной жизни, позволяя нам производить различные продукты более эффективно и экологически безопасно.
Основным свойством катализатора является его способность снижать энергию активации химической реакции, то есть энергию, которую реагирующие вещества должны преодолеть, чтобы начать реакцию. Благодаря катализатору, реакция может произойти при более низкой температуре и с меньшими количествами реагентов.
Катализаторы используются в самых разных отраслях промышленности: от нефтепереработки и производства пластмасс до производства лекарственных препаратов и пищевых продуктов. Они могут быть различными по своей природе – металлическими, кислотными, ферментными и др. Без катализаторов множество процессов очень медленные или не происходят вовсе.
Катализаторы не только ускоряют химические реакции, но и снижают затраты на производство, позволяя снизить стоимость конечного продукта. Они также позволяют проводить реакции при более низких температурах, что способствует сохранению энергии и защите окружающей среды.
Благодаря катализаторам мы можем получать новые материалы, разрабатывать новые технологии и улучшать существующие процессы. Их изучение и разработка новых катализаторов являются активной областью научных исследований. Понимание принципов действия катализаторов помогает нам добиться большей эффективности и устойчивости в промышленности и создать более чистую и энергоэффективную среду.
Значение катализатора в химических реакциях

Катализаторы могут быть разных типов: гетерогенные и гомогенные. Гетерогенные катализаторы находятся в различной фазе с реагентами и образуют активные центры на своей поверхности. Гомогенные катализаторы растворены в реакционной среде и взаимодействуют с реагентами в одной фазе.
Еще одной важной характеристикой катализаторов является их специфичность. Катализаторы могут быть общими, когда они активны для нескольких реакций, или специфичными, когда они активны только для одной конкретной реакции.
Важно отметить, что катализаторы не влияют на равновесие химической реакции - они только ускоряют ее скорость. Они не меняют начальные и конечные продукты реакции, а только способствуют более быстрому образованию продуктов из реагентов.
Значение катализатора в химических реакциях трудно переоценить. Благодаря катализу, многие процессы становятся возможными на практике. Катализаторы применяются в широком спектре отраслей, таких как производство химических веществ, нефтехимия, продукты питания, фармацевтика и другие.
Как катализатор ускоряет химические реакции
Ускорение химической реакции происходит в присутствии катализатора благодаря следующему механизму:
- Абсорбция реагентов: Катализатор притягивает реагенты на свою поверхность, облегчая их взаимодействие.
- Повышение концентрации реагентов: Катализатор увеличивает концентрацию реагентов на своей поверхности, создавая благоприятные условия для реакции.
- Образование промежуточных соединений: Катализатор образует промежуточные соединения, которые являются более активными и способствуют быстрому протеканию реакции.
- Уменьшение энергии активации: Катализатор снижает энергию активации, необходимую для разрыва и образования химических связей, ускоряя реакцию.
- Регенерация катализатора: После завершения реакции, катализатор возвращается в свою исходную форму и может быть использован вновь.
Таким образом, катализаторы играют важную роль в промышленности и химической лаборатории, позволяя существенно ускорить химические процессы и повысить их эффективность.
Роль катализатора в выборе пути реакции
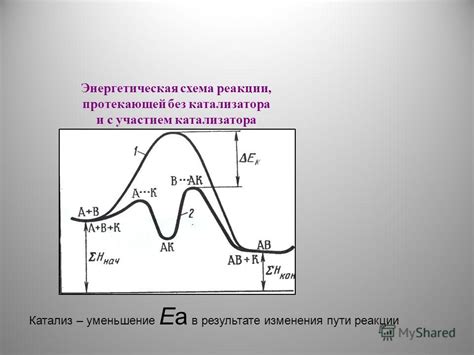
Когда реакция протекает без катализатора, существуют различные пути, по которым могут образоваться конечные продукты. Однако, наличие катализатора может значительно изменить процесс. Он может активировать определенные пути реакции, обеспечивая более эффективное и предпочтительное образование продуктов.
Катализаторы обладают специальными свойствами, которые позволяют им влиять на реакцию. Они могут образовывать временные связи с реагентами, создавая более благоприятные условия для их превращения в продукты. Они также могут стабилизировать промежуточные состояния реакций, осуществлять регулировку протекания процесса, и отсеивать нежелательные пути.
Катализаторы часто применяются для увеличения скорости реакции, экономии реагентов и энергии, а также для повышения выбора определенного пути.
Благодаря своей специфичности и высокой эффективности влияния на реакции, катализаторы находят широкое применение в различных областях химии и промышленности, от производства пищевых продуктов и фармацевтики до катализахимических процессов.
Катализатор: важный ингредиент для промышленных процессов
Промышленные процессы во многих отраслях, таких как производство пластика, удобрений, пищевых продуктов и других, часто не могут обходиться без катализаторов. Катализаторы позволяют существенно снизить температуру и давление, необходимые для проведения реакции, что экономит энергию и снижает затраты на производство. Они также увеличивают выбор продуктов реакции и повышают его эффективность.
Катализаторы могут быть использованы в форме гетерогенного или гомогенного катализа. Гетерогенные катализаторы находятся в разных фазах с реагирующими веществами, например, металлические катализаторы в порошковой форме. Гомогенные катализаторы смешиваются с реагирующими веществами в одной фазе, например, растворимые соединения.
Катализаторы могут быть металлическими, окислительно-восстановительными, кислотными или базовыми. Каждый тип катализатора имеет свои особенности и оптимальные условия применения.
Кроме промышленных процессов, катализаторы также широко используются в автомобильной промышленности, например, в катализаторах для снижения выбросов вредных веществ в выхлопных газах. Они также играют важную роль в фармацевтической, нефтяной и других отраслях.
Катализаторы имеют большое значение для развития новых технологий и улучшения существующих процессов. Благодаря своему влиянию на химические реакции, они помогают экономить ресурсы и улучшают экологическую обстановку. Поэтому изучение и применение катализаторов остается актуальной и перспективной областью научных исследований.








