Ковалентная связь - одна из форм химических связей, при которой два атома обменивают одну или несколько пар электронов. При этом возникает силовое взаимодействие, которое держит атомы вместе. В зависимости от разности электроотрицательности атомов, ковалентная связь может быть полярной или неполярной.
Различие между полярной и неполярной ковалентной связью заключается в наличии или отсутствии разности электроотрицательности атомов, образующих связь. Если атомы имеют разные электроотрицательности, то электроны не делятся равномерно, и возникает полярная ковалентная связь. В этом случае один атом притягивает электроны сильнее, чем другой, и образуется частичный положительный и частичный отрицательный заряды.
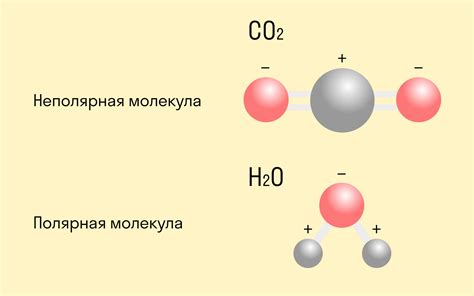
Неполярная ковалентная связь возникает, когда разность электроотрицательности атомов равна нулю или очень мала. В этом случае электроны делятся равномерно между атомами, и заряды не образуются. Важно отметить, что полярность ковалентной связи может быть разной степени - от слабой до сильной, в зависимости от разности электроотрицательности.
Полярная и неполярная ковалентная связь имеют важное значение в химии и имеют разные физические и химические свойства. Полярные связи способствуют образованию дипольных молекул, которые обладают полярным моментом. Это может влиять на растворимость веществ, их тепловые свойства и способность к образованию химических соединений. Неполярные связи, в свою очередь, обычно характеризуются отсутствием полярного момента и слабыми взаимодействиями между молекулами.
Что такое ковалентная связь
В ковалентной связи электроны располагаются в общих электронных оболочках двух атомов, образуя общую пару электронов. При этом оба атома электрически нейтральны, но становятся зарядовыми из-за общих электронов. Ковалентная связь стабильна и обладает средней прочностью.
Ковалентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов. В полярной ковалентной связи электроны не равномерно распределены между атомами, что создает разность зарядов и дипольный момент. В неполярной ковалентной связи электроны равномерно распределены и дипольный момент отсутствует.
Ковалентная связь играет важную роль во многих процессах и структурах, таких как образование молекул, полимеров и кристаллических сеток. Она позволяет образовывать и удерживать атомы вместе, обеспечивая стабильность и функциональность химических соединений.
Определение и принцип образования
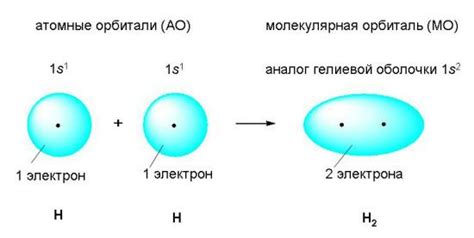
Ковалентная связь представляет собой химическую связь между атомами, основанную на общем использовании электронных пар. Она возникает, когда два атома разделяют электроны своих внешних оболочек и образуют общие электронные пары, обеспечивая стабильность обоим атомам.
Основным принципом формирования ковалентной связи является стремление атомов достичь состояния стабильности, а именно, заполнить внешнюю электронную оболочку таким образом, чтобы у каждого атома было восемь электронов (включая общие электронные пары).
Для образования ковалентной связи атомы привлекаются друг к другу за счет электростатического взаимодействия и образуют молекулы. Однако при этом важно отличать полярную и неполярную ковалентную связь.
Особенности атомов и молекул в ковалентной связи
Атомы, которые участвуют в ковалентной связи, имеют различные особенности. Во-первых, атомы в ковалентной связи часто имеют одинаковые или близкие радиусы. Это позволяет электронам быть распределенными равномерно между атомами и создавать электронную облако, которое связывает их вместе.
Кроме того, атомы в ковалентной связи могут иметь разные электроотрицательности. Электроотрицательность – это способность атома привлекать электроны к себе. Если разница в электроотрицательности между атомами отличается, ковалентная связь может быть полярной. В полярной ковалентной связи один атом становится немного заряженным положительно, а другой – заряженным отрицательно.
В полярной ковалентной связи атомы с разной электроотрицательностью создаются диполем, который может быть ориентирован в пространстве. Это означает, что полярная ковалентная связь может быть направлена или иметь определенную полярность. С другой стороны, в неполярной ковалентной связи разница в электроотрицательности между атомами незначительна, и электроны обмениваются равномерно между ними.
Особенности атомов и молекул в ковалентной связи весьма значимы. Ковалентные связи представляют собой сильные и стабильные связи, которые обеспечивают формирование молекул. Различия в электроотрицательности атомов в ковалентной связи позволяют молекулам обладать различными химическими свойствами и реактивностью. Полярные молекулы могут образовывать водородные связи и проявлять поларные свойства, такие как растворимость в воде. С другой стороны, неполярные молекулы обычно обладают меньшей поларностью и могут быть нерастворимыми в воде.
| Тип ковалентной связи | Разница в электроотрицательности | Ориентация диполя |
|---|---|---|
| Полярная | Значительная | Ориентированная |
| Неполярная | Незначительная | Отсутствует |
Полярная ковалентная связь и ее характеристики
Существует несколько факторов, которые влияют на положительный и отрицательный заряд в полярной ковалентной связи:
- Электроотрицательность атомов: атомы с различными электроотрицательностями образуют полярные связи, поскольку они притягивают электроны к себе сильнее, чем другие атомы.
- Геометрия молекулы: форма молекулы и углы между связями влияют на распределение электронов и, следовательно, на положительный и отрицательный заряд в молекуле.
- Различие в размерах атомов: если атомы в полярной ковалентной связи имеют значительное различие в размерах, это также влияет на положительный и отрицательный заряд молекулы.
Полярная ковалентная связь обладает несколькими характеристиками:
- Наличие полярности: в полярной ковалентной связи одна сторона связи обладает отрицательным зарядом, а другая - положительным. Такое разделение заряда создает полярность в молекуле.
- Образование диполя: в полярной ковалентной связи возникает дипольный момент, так как положительный и отрицательный заряды не совпадают и создают разделение зарядов в молекуле.
- Образование водородных связей: полярная ковалентная связь может быть основой для образования водородных связей, которые способствуют образованию стабильных структур в различных соединениях.
Полярная ковалентная связь играет важную роль во многих химических реакциях и определяет свойства многих соединений. Она может влиять на физические свойства вещества, такие как температура плавления и кипения, солубильность и электропроводность.
Как образуется полярная связь
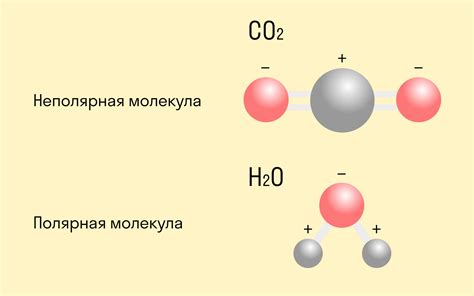
Полярная ковалентная связь образуется между атомами, когда один атом притягивает электроны общей пары сильнее, чем другой атом. Это происходит из-за наличия различия в электроотрицательности атомов.
Электроотрицательность – это способность атома притягивать к себе электроны. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны общей пары к себе. Когда атомы с разной электроотрицательностью образуют ковалентную связь, электроны общей пары смещаются ближе к атому с более высокой электроотрицательностью.
Разность в электроотрицательности атомов обозначается как ΔEN. Если ΔEN больше 1,7, то связь между атомами считается ионной. Если ΔEN меньше 0,5, то связь считается неполярной ковалентной связью. А если ΔEN находится в диапазоне от 0,5 до 1,7, то связь называется полярной ковалентной связью.
Полярная ковалентная связь вызывает появление диполя – разделения зарядов в молекуле. Атом с более высокой электроотрицательностью приобретает частичный отрицательный заряд, а атом с более низкой электроотрицательностью – частичный положительный заряд. Это образует полярность молекулы.
Отличие полярной связи от неполярной
Полярная связь происходит, когда электроотрицательности атомов, образующих связь, отличаются. В таком случае, электронная область связи смещается ближе к более электроотрицательному атому, создавая положительный и отрицательный полюс внутри молекулы. Это приводит к образованию диполя, и молекула становится полярной.
Неполярная связь возникает, когда электроотрицательности атомов, образующих связь, одинаковы или очень близки. В таком случае, электронная область связи равномерно распределена между атомами, и внутри молекулы отсутствуют положительные и отрицательные полюса. Молекула является неполярной и не обладает дипольным моментом.
Отличие между полярной и неполярной связью имеет важное значение в химических реакциях и взаимодействиях молекул. Полярные молекулы имеют высокую растворимость в полярных растворителях, таких как вода, и образуют с ними стабильные смеси. Неполярные молекулы, напротив, растворяются лучше в неполярных растворителях, таких как бензол или гексан. Кроме того, полярные и неполярные связи оказывают влияние на внутримолекулярные силы, влияющие на температуру плавления и кипения молекулы.








