Химический процесс – это преобразование вещества или группы веществ в другие вещества. Он основан на изменении химического состава и структуры атомов и молекул. Химические процессы происходят во всех сферах нашей жизни, от приготовления пищи до производства лекарств и взрывчатых веществ.
Химические процессы могут происходить под воздействием различных факторов, таких как температура, давление, концентрация реагентов и наличие катализаторов. В процессе химических реакций можно наблюдать изменение цвета, образование газов, образование твердых осадков или изменение физических свойств исходных веществ.
Примером химического процесса является горение древесины. Под действием высокой температуры, древесина вступает в химическую реакцию с кислородом из воздуха, в результате которой образуются диоксид углерода и вода. Эта реакция сопровождается выделением большого количества теплоты и света. Также в процессе горения древесины могут образовываться другие вещества, такие как дым, сажа и выходящие газы, которые могут быть опасны для здоровья.
В химии существуют различные типы химических процессов, включая окислительно-восстановительные реакции, реакции синтеза, реакции разложения, реакции комплексообразования и многие другие. Каждый из этих процессов имеет свои особенности и применимость в различных областях науки и промышленности.
Понятие химического процесса

Химические процессы могут происходить как в природе, так и в лабораторных условиях. В природе химические процессы играют важную роль в жизни всех организмов, они позволяют синтезировать необходимые для жизни вещества и обеспечивают обмен веществ.
Примеры химических процессов:
- Окисление железа при взаимодействии с кислородом воздуха, что приводит к появлению ржавчины.
- Горение древесины или топлива, при котором происходит реакция с кислородом с образованием углекислого газа и выделением тепла и света.
- Получение газообразного хлора путем электролиза раствора соли.
- Синтез аммиака из азота и водорода.
Химические процессы являются основой многих отраслей науки и промышленности. Они позволяют разрабатывать новые материалы, лекарственные препараты, технологии и улучшать существующие процессы.
Особенности химического процесса
1. Изменение состава веществ
Химический процесс приводит к изменению состава веществ, включенных в реакцию. В результате химической реакции могут образовываться новые вещества с другими свойствами и составом.
2. Соблюдение закона сохранения массы и энергии
Химический процесс должен соблюдать закон сохранения массы и энергии. Это означает, что в химической реакции масса веществ, участвующих в реакции, остается неизменной, а энергия, выделяющаяся или поглощающаяся при реакции, также остается постоянной.
3. Взаимодействие молекул
Химический процесс осуществляется за счет взаимодействия молекул. Молекулы веществ вступают во взаимодействие друг с другом, меняют свою структуру и образуют новые соединения.
4. Изменение энергии
Химический процесс может сопровождаться выделением или поглощением энергии. В реакциях могут происходить химические превращения, сопровождающиеся выделением или поглощением тепла или света.
5. Скорость реакции
Химический процесс может происходить с различной скоростью. Скорость реакции зависит от различных факторов, включая концентрацию веществ, температуру, давление и наличие катализаторов.
Таким образом, химический процесс представляет собой сложное явление, которое происходит при взаимодействии химических веществ и включает в себя изменение состава веществ, соблюдение закона сохранения массы и энергии, взаимодействие молекул, изменение энергии и скорость реакции.
Важность химического процесса

Важность химического процесса заключается в его способности превращать одни вещества в другие. Это позволяет нам создавать новые и полезные материалы, улучшать качество продукции и разрабатывать инновационные технологии.
Химические процессы также имеют важное значение для сохранения окружающей среды. Например, они позволяют очищать загрязненную воду и воздух, перерабатывать отходы и снижать вредные выбросы в атмосферу. Благодаря химическим процессам мы можем более эффективно использовать природные ресурсы и снижать негативное влияние промышленности на окружающую среду.
В области науки и исследований химические процессы играют ключевую роль. Они помогают нам понять структуру и свойства веществ, разрабатывать новые материалы и технологии, а также разрабатывать новые методы исследования.
Таким образом, химический процесс имеет большую важность в различных отраслях человеческой деятельности, от промышленности до науки и медицины.
Примеры химических процессов в ежедневной жизни
| Пример химического процесса | Объяснение |
|---|---|
| Окисление пищи в организме | Этот процесс, известный как клеточное дыхание, происходит в наших клетках и является основным источником энергии для нашего организма. Окисление пищи происходит благодаря химическим реакциям, при которых углеводы, жиры и белки разлагаются и превращаются в энергию. |
| Горение дров в камине | Горение является химическим процессом, при котором вещества окисляются и выделяются тепло и свет. При горении дров в камине, древесина реагирует с кислородом из воздуха и образуются углекислый газ и вода, при этом выделяется тепло, которое согревает помещение. |
| Ферментация для производства алкоголя | Ферментация - это химический процесс, при котором микроорганизмы (например, дрожжи) превращают сахары в алкоголь и углекислый газ. Этот процесс используется в производстве алкогольных напитков, таких как вино и пиво. |
| Реакция замачивания | Реакция замачивания - это процесс, при котором вода взаимодействует с определенными веществами, такими как мука или сахар. Например, при приготовлении теста для печенек, мука вступает в реакцию замачивания с водой, что приводит к образованию клейкой массы. |
Химические процессы в промышленности

Промышленные химические процессы могут быть разделены на несколько категорий в зависимости от их целей и используемых реакций. Одним из примеров химического процесса в промышленности является процесс получения аммиака. Аммиак широко используется в производстве удобрений, пластмасс и других химических соединений. Процесс получения аммиака основан на габер-Бошевской реакции, при которой азот и водород превращаются в аммиак.
Еще одним примером химического процесса в промышленности является процесс синтеза полимеров. Полимеры - это длинные цепочки макромолекул, которые образуют пластик, резину и другие материалы. Процесс синтеза полимеров включает полимеризацию мономеров, при которой они соединяются в длинные цепи.
Кроме того, химические процессы используются для получения различных химических соединений, таких как кислоты, щелочи, соли и другие. Эти соединения широко используются в производстве различных продуктов, от бытовой химии до фармацевтики.
Химические процессы в промышленности обычно проводятся в специальных реакторах и требуют строгого контроля условий: температуры, давления, концентрации веществ и т. д. Важно обеспечить безопасность и эффективность процессов, чтобы минимизировать отходы и получить высококачественные продукты.
Таким образом, химические процессы играют ключевую роль в промышленности, обеспечивая производство различных химических продуктов и материалов. Они являются основой многих производственных процессов и требуют специальных знаний и навыков для их эффективного проведения.
Химические реакции и химические процессы
Химические реакции можно обозначать с помощью химических уравнений, в которых указываются реагенты, продукты и коэффициенты перед формулами веществ. Например, уравнение химической реакции сгорания метана выглядит следующим образом:
CH4 + 2O2 → CO2 + 2H2O
Химические реакции классифицируются по различным признакам, например, по типу превращения веществ, по скорости протекания, по условиям проведения и т. д.
Химические процессы представляют собой более общее понятие, которое включает в себя не только химические реакции, но и другие изменения, происходящие с веществами. К химическим процессам относятся, например, физическое растворение веществ, сорбция, каталитические процессы и др.
Химические процессы могут происходить в различных условиях: при повышенной или пониженной температуре, при наличии катализаторов, в разных средах (жидкой, газовой, твердой) и т. д. Они имеют важное значение в различных областях жизни, таких как промышленность, медицина, пищевая промышленность и др.
Примеры химических процессов включают реакции образования соли, электролиз, окисление металлов, горение и другие.
Типы химических процессов

Химические процессы классифицируются по разным основаниям, в том числе по термодинамическим условиям, происходящим изменениям и природе взаимодействующих веществ. Вот некоторые типы химических процессов:
| Тип процесса | Описание | Примеры |
|---|---|---|
| Синтез | Образование нового вещества путем соединения элементов или соединений | Синтез ацетилена, синтез аммиака |
| Диссоциация | Распад вещества на более простые компоненты | Диссоциация воды, диссоциация солей |
| Окисление-восстановление | Передача электронов между веществами, сопровождающаяся изменением степени окисления | Горение кислородом, восстановление металлов из их оксидов |
| Гидролиз | Разложение вещества с помощью воды | Гидролиз солей, гидролиз эфиров |
| Полимеризация | Образование полимера из мономера или многочисленных мономеров | Полимеризация этилена, полимеризация стирола |
| Каталитический процесс | Процесс, в котором катализатор ускоряет химическую реакцию без участия в ней | Каталитический гидрирование, каталитический окислительный процесс |
Эти типы химических процессов широко используются в научных и промышленных приложениях, а также в повседневной жизни.
Влияние факторов на химический процесс
- Концентрация реагентов: повышение концентрации реагентов обычно ускоряет реакцию, так как большее количество реагентов приводит к более частым столкновениям между частицами, что увеличивает вероятность образования продуктов.
- Температура: повышение температуры обычно повышает скорость реакции, так как увеличивает энергию столкновения частиц, что способствует преодолению энергии активации и более эффективному образованию продуктов.
- Катализаторы: катализаторы могут повысить скорость реакции, уменьшая энергию активации и облегчая реакцию без изменения исходных реагентов или продуктов.
- Давление: повышение давления обычно увеличивает скорость реакции в газовой фазе, так как сжатие газов приводит к более частым столкновениям и образованию продуктов.
- Поверхность и разделение фаз: увеличение поверхности реагентов или разделение их на несколько фаз может повысить скорость реакции, так как большая площадь контакта способствует более эффективному столкновению частиц и образованию продуктов.
Влияние этих факторов на химический процесс может быть комбинированным и зависит от конкретной реакции и условий.
Регулирование химических процессов
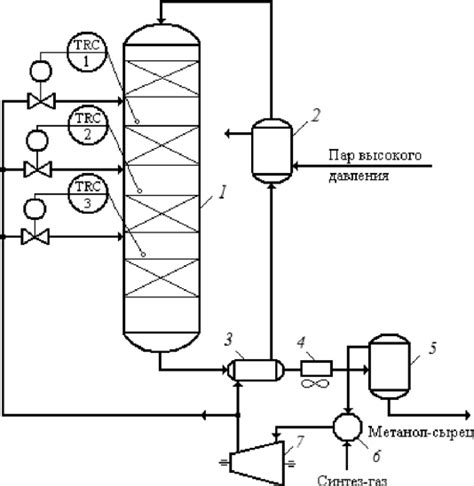
Существует несколько методов регулирования химических процессов, включая:
Температурное регулирование: Изменение температуры может значительно влиять на скорость химической реакции. Увеличение температуры может ускорить реакцию, в то время как снижение температуры может замедлить ее. Контроль температуры может быть достигнут с помощью термостатов и систем охлаждения.
Концентрационное регулирование: Изменение концентрации реагентов может изменять скорость реакции. Увеличение концентрации реагентов может ускорить реакцию, в то время как снижение концентрации может замедлить ее. Регулирование концентрации может быть достигнуто путем изменения объема добавляемых реагентов.
Использование катализаторов: Катализаторы - это вещества, которые ускоряют химическую реакцию, участвуя в ней, но не расходуясь при этом. Они могут быть добавлены к реакционной смеси, чтобы повысить скорость реакции или изменить ее направление.
Регулирование рН: Уровень кислотности или щелочности среды может оказывать влияние на скорость химической реакции. Изменение рН может изменить скорость или направление реакции. Регулирование рН может быть достигнуто с помощью добавления кислоты или щелочи в реакционную смесь.
Регулирование химических процессов позволяет управлять процессом реакции и достичь желаемого результата. Оно является важным инструментом в промышленности, фармацевтике, пищевой и других отраслях, где химические процессы играют решающую роль.








