Валентность атома – это количество валентных электронов, представляющих электронную оболочку атома. Валентные электроны в атоме отвечают за химические связи и реактивность атома, поэтому их значение весьма важно для понимания химических процессов.
Валентные электроны находятся на внешней энергетической уровне атома, который называется валентной оболочкой. Количество валентных электронов определяется номером главной группы, в которой расположен атом в периодической системе элементов. Например, атомы в первой главной группе имеют один валентный электрон, во второй – два, в третьей – три и так далее.
Валентность атома – это также число связей, которые он способен образовать при химических реакциях. Атомы с меньшим количеством валентных электронов обычно стремятся завершить свою валентную оболочку путем образования связей с другими атомами. Такие атомы, называемые электронно дефицитными, обладают положительной валентностью. Атомы с лишними валентными электронами, называемыми электронно-избыточными, могут образовывать новые связи с другими атомами или участвовать в обмене электронами, обладая отрицательной валентностью.
Знание значения валентных электронов не только позволяет лучше понять химические связи и реактивность атомов, но и является ключом к пониманию реакций и взаимодействий между различными веществами. Оно открывает возможности для создания новых веществ и материалов, а также разработки новых методов синтеза и модификации химических соединений.
Понятие валентных электронов
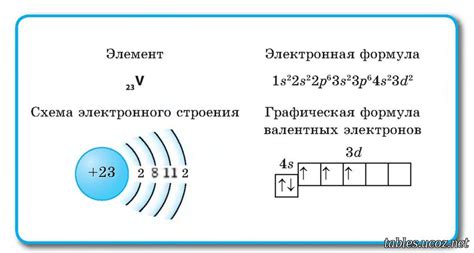
Валентные электроны имеют наибольшую энергию среди всех электронов в атоме, так как они находятся на большом расстоянии от ядра. Число валентных электронов определяет группу элемента в периодической системе Мен
Роль валентных электронов в химических реакциях
Валентные электроны атома играют важную роль во многих химических реакциях. Они определяют химические свойства атома и его способность вступать в химические соединения. Валентные электроны находятся в самом внешнем энергетическом уровне атома и влияют на его реакционную способность.
Реакционная способность атома определяется его способностью вступать в ковалентные связи с другими атомами. Атомы стремятся достичь электронной конфигурации благородного газа, то есть иметь полностью заполненные энергетические уровни. Для этого атомы могут образовывать связи с другими атомами, обменявшись или передав электроны своего внешнего энергетического уровня – валентных электронов.
Наличие восеми валентных электронов на внешнем энергетическом уровне атома приводит к особому состоянию стабильности, такому как у эдельгазов. Поэтому атомы стремятся приблизиться к этому состоянию и достичь стабильности путем образования химических соединений.
Валентные электроны могут быть участвовать в различных типах химических связей, таких как ионная связь, ковалентная связь и металлическая связь. В химических реакциях атомы могут обмениваться валентными электронами, создавая новые химические соединения и образуя связи между собой.
Изменение количества валентных электронов в атоме в результате химической реакции позволяет атому изменить свою реакционную способность. Атомы с неполными валентными электронными оболочками имеют большую активность и наиболее активно взаимодействуют с другими атомами для заполнения своих валентных уровней.
Таким образом, валентные электроны играют решающую роль в химических реакциях, определяя взаимодействие атомов и образование химических соединений.
Число валентных электронов

Количество валентных электронов можно определить для каждого элемента, используя таблицу Менделеева. Количество валентных электронов общепринято указывать в виде индекса справа от символа элемента.
Число валентных электронов может быть равно от одного до восьми. Элементы с одним электроном в валентной оболочке обладают максимальной реакционной активностью и стремятся передать или принять один электрон, чтобы заполнить или освободить валентную оболочку. Элементы с восьмью электронами в валентной оболочке обладают наибольшей стабильностью и не проявляют химической активности, так как они обладают полной октетной структурой.
Число валентных электронов также играет важную роль в определении электронной формулы соединения и составления моделей соединений и молекул.
Влияние числа валентных электронов на химические свойства
Число валентных электронов атома играет важную роль в его химических свойствах. Валентные электроны находятся на самых высокоэнергетических оболочках и определяют возможные химические реакции и соединения, в которых может участвовать атом.
Атомы с малым числом валентных электронов обычно образуют ионические соединения, передавая свои электроны другим атомам с высоким числом валентных электронов. Это объясняет, почему некоторые химические элементы имеют тенденцию образовывать ионы положительного или отрицательного заряда.
Атомы с большим числом валентных электронов имеют большую склонность образовывать ковалентные связи с другими атомами, путем передачи, обмена или перекрывания электронов. Чем больше валентных электронов у атома, тем больше возможностей для образования различных ковалентных связей и молекул.
Число валентных электронов также определяет химические свойства элементов в периодической системе. Например, элементы, находящиеся в одной группе периодической системы, имеют одинаковое число валентных электронов и, следовательно, схожие химические свойства. Это позволяет организовать элементы в группы с общими свойствами и предсказывать их химические реакции и соединения.
Таким образом, число валентных электронов играет важную роль в определении химических свойств атомов и элементов. Оно определяет их способность образовывать соединения, обменять или передать электроны, а также их положение в периодической системе и их связь с другими элементами.
Валентность атома
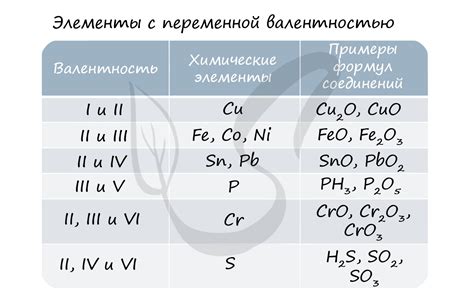
Валентность атома зависит от количества электронов на его внешнем энергетическом уровне, который называется валентным энергетическим уровнем или валентной оболочкой. Этот уровень может содержать от одного до восьми электронов.
Основная валентность - это количество электронов на валентном энергетическом уровне. Она определяется группой элементов в периодической таблице. Например, для вещества, принадлежащего группе 1 (щелочные металлы), основная валентность будет равна 1, потому что на их валентном энергетическом уровне находится один электрон. Для элементов группы 2 (щелочноземельные металлы) основная валентность будет равна 2, так как на их валентном энергетическом уровне располагается два электрона.
Иногда атомы могут иметь не только основную валентность, но и дополнительные. Дополнительная валентность возникает, когда атом может принять дополнительные электроны или отдать уже имеющиеся. Например, у некоторых химических элементов есть возможность принимать или отдавать электроны так, что на их валентном энергетическом уровне будет больше или меньше электронов, чем обычно.
Валентность атома является ключевым понятием в химии, так как она определяет возможность образования химических соединений и реакций. Знание валентности атомов позволяет строить химические формулы и предсказывать свойства вещества.
Изменение валентности в периодической таблице
Валентность атома химического элемента определяется числом валентных электронов, находящихся в его внешней электронной оболочке. Валентные электроны играют ключевую роль в химических реакциях и образовании химических связей. Однако валентность атома может изменяться в зависимости от его положения в периодической таблице.
Наиболее ярким примером изменения валентности является серия элементов периодической таблицы, известная как элементы главных подгрупп. В этой серии валентность элементов возрастает по мере движения от левого крайнего столбца к правому крайнему столбцу.
В первой главной подгруппе находятся щелочные металлы - элементы от лития до франция. Все они имеют одну валентность, равную +1. Это связано с тем, что у них в внешней электронной оболочке находится всего один электрон. Таким образом, эти металлы готовы отдать один электрон, чтобы достичь стабильной октаэдрической структуры.
Во второй главной подгруппе находятся щелочноземельные металлы - элементы от бериллия до радия. Валентность этих элементов равна +2. Это связано с наличием у них двух валентных электронов. Они готовы отдать эти два электрона, чтобы достичь стабильной октаэдрической структуры.
В третьей главной подгруппе находятся элементы от скандия до актиния. Валентность этих элементов может изменяться от +3 до +6. Отличие валентности связано с наличием большего количества валентных электронов и разным количеством оболочек. Например, у скандия 3 валентных электрона, у фосфора 5, а у серы 6.
Таким образом, периодическая таблица предоставляет удобный инструмент для определения валентности элемента в зависимости от его положения и химических свойств. Изменение валентности в периодической таблице позволяет предсказывать и объяснять реакции между различными элементами и их химическое поведение.








