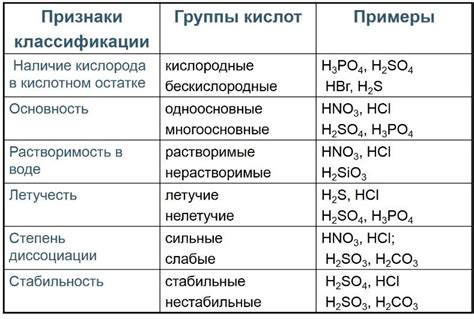
Сила кислоты - это химическая характеристика, которая определяет ее способность отдавать протоны. Протоны - это частицы, которые играют важную роль во многих химических реакциях. Кислоты могут быть разного вида: органические и неорганические, слабые и сильные. Сила кислоты может быть измерена по ее константе диссоциации - это значение, которое показывает, какая часть молекулы кислоты будет диссоциировать в растворе.
Сила кислоты играет важную роль в химических реакциях. Когда сильная кислота реагирует с основанием, происходит нейтрализация, при которой образуется соль и вода. Нейтрализационные реакции используются в различных процессах, таких как производство удобрений из аммиака и солей, а также в медицине для лечения расстройств желудка.
Сила кислоты также влияет на скорость химических реакций. Сильные кислоты могут быстрее реагировать с другими веществами, чем слабые. Это связано с тем, что сильные кислоты легче отдают протоны, что способствует более быстрой реакции. Основания также могут влиять на скорость реакции, так как они принимают протоны от кислот и образуют соль.
Итак, сила кислоты играет важную роль в химических реакциях. Она определяет способность кислоты отдавать протоны и влияет на скорость химических процессов. На практике это приводит к различным приложениям кислот, использующих нейтрализацию и ускорение химических реакций. Понимание силы кислоты позволяет ученым и инженерам выбирать наиболее подходящие кислоты для конкретных задач и улучшать процессы в промышленности и медицине.
Сила кислоты и её значимость в химических реакциях
Кислоты обладают различной степенью силы, которая выражается через величину ионизации. Чем выше степень ионизации, тем сильнее кислота и легче она отдает протоны в реакцию.
Сильные кислоты, такие как соляная кислота (HCl) и серная кислота (H2SO4), полностью диссоциируют в водном растворе и отделяют все свои протоны. Они являются активными реагентами в различных химических процессах.
Слабые кислоты, например, уксусная кислота (CH3COOH) и угольная кислота (H2CO3), имеют невысокую степень ионизации и не диссоциируют полностью. Они не всегда являются активными участниками химических реакций.
Сила кислоты играет важную роль в множестве химических реакций. Она может влиять на скорость реакции, образование и разрушение химических связей, а также на образование осадков и изменение окраски веществ.
Кроме того, сила кислоты может изменять pH раствора, в котором она находится. Кислотные растворы с низким pH (меньше 7) обладают большей кислотностью и могут вызывать раздражение и коррозию. Это важно учитывать при обращении с кислотными веществами.
В заключение, сила кислоты определяет её активность и реакционную способность. Это позволяет использовать кислоты в различных химических процессах и обеспечивает их значимость в химии.
Различные свойства кислот
Кислоты обладают несколькими основными свойствами, которые определяют их химическое поведение и влияют на проведение химических реакций:
- Кислотность: кислоты обладают кислотными свойствами и могут выделять протоны (H+) при реакции с основаниями или растворяться в воде, образуя водные растворы кислот. Кислотность кислот определяется их способностью выделять протоны.
- Электролитическая природа: кислоты, как правило, являются электролитами, то есть они диссоциируют в воде на положительно заряженные H+ и отрицательно заряженные ионы кислотного остатка.
- Окислительные свойства: некоторые кислоты обладают окислительными свойствами и могут принимать от других веществ электроны. Это используется, например, в аналитической химии для определения содержания веществ в растворе.
- Реакция с металлами: некоторые кислоты реагируют с металлами, образуя соли и выделяя водород.
- Коррозионная активность: кислоты могут вызывать коррозию металлов и других материалов, так как их кислотные свойства способствуют разрушению химических связей в материале.
Комбинация этих свойств делает кислоты важными соединениями в химической промышленности и научных исследованиях, а также определяет их применение в различных областях жизни - от медицины до производства.
Факторы, влияющие на силу кислоты
1. Положение равновесия
Сила кислоты зависит от положения равновесия между кислотными и конъюгированными базами водородных ионов. Чем больше процент ионизованных кислотных молекул в растворе, тем сильнее кислота.
2. Электроотрицательность
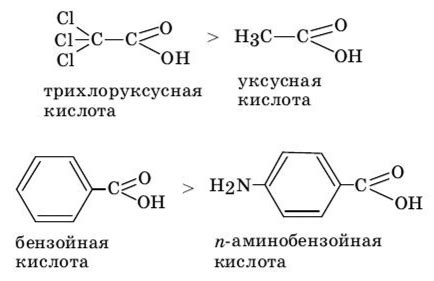
Электроотрицательные элементы создают более кислотные оксиды, что влияет на силу кислоты. Чем больше разница в электроотрицательности между элементами, тем сильнее кислота.
3. Размер заряда
Чем больше заряд катиона в кислоте, тем сильнее она будет отдавать протоны. Кислоты с многозарядными катионами обычно являются сильными кислотами.
4. Полярность
Полярные кислоты (с диполь-моментом) обычно являются более сильными, так как они имеют большую способность отдавать или делиться протонами.
5. Растворимость
Растворимость кислоты в воде также влияет на ее силу. Кислоты, хорошо растворяющиеся в воде и полностью ионизирующиеся, считаются сильными кислотами.
Учет этих факторов помогает определить силу кислоты и предсказать ее поведение в химических реакциях.
Как сила кислоты влияет на реакции с основаниями
Сила кислоты играет важную роль в химических реакциях с основаниями. Она определяет, насколько активно кислотные молекулы будут отдавать протоны основаниям. Сильные кислоты, такие как соляная кислота и серная кислота, обладают высокой способностью отдавать протоны и реагировать с основаниями. В результате таких реакций образуются соли и вода.
С другой стороны, слабые кислоты, такие как уксусная кислота и молочная кислота, не отдают протоны так активно. Поэтому реакции с основаниями происходят медленнее и в меньшей степени. В конечном итоге образуются слабые соли и вода.
Сила кислоты определяется ее степенью диссоциации в водном растворе. Чем выше степень диссоциации, тем сильнее кислота. Для сильных кислот степень диссоциации близка к 100%, а для слабых - намного ниже.
На реакцию между кислотой и основанием также влияет концентрация реагентов и условия реакции. Высокая концентрация кислоты или основания, а также высокая температура, могут способствовать быстрой и полной реакции.
Важно отметить, что сила кислоты не всегда прямо связана с ее коррозионными свойствами. Некоторые слабые кислоты, например уксусная кислота, могут быть коррозионно активными при достаточно высокой концентрации или в присутствии других реагентов.
В итоге, понимание силы кислоты и ее влияния на реакции с основаниями позволяет предсказывать и контролировать результаты химических превращений и эффективно использовать кислотные реакции в различных областях науки и технологии.
| Сильные кислоты | Слабые кислоты |
|---|---|
| Соляная кислота (HCl) | Уксусная кислота (CH3COOH) |
| Серная кислота (H2SO4) | Молочная кислота (CH3CH(OH)COOH) |
| Соляная кислота (HCl) | Уксусная кислота (CH3COOH) |
Значение силы кислоты в органической химии

Сила кислоты играет важную роль в органической химии. Она определяет, насколько легко кислотные соединения могут отдавать протоны или протонировать другие вещества. Сила кислоты в органической химии напрямую связана с электрохимическими свойствами молекулы.
Сильные кислоты обладают высокой способностью отдавать протоны, такие, как сульфоновые или карбоксильные кислоты. Они могут растворяться в воде и полностью диссоциировать, образуя ионы водорода (H+). Ионы H+ играют роль во многих реакциях органической химии.
Слабые кислоты, например, фенолы или спирты, обладают меньшей способностью отдавать протоны. Они частично диссоциируют в воде, образуя ионы H+, но в меньшем количестве. Слабые кислоты могут участвовать в различных реакциях, но их реакционная активность ниже, чем у сильных кислот.
| Сильные кислоты | Слабые кислоты |
|---|---|
| Сульфоновые кислоты | Фенолы |
| Карбоксильные кислоты | Спирты |
| Перекись водорода | Амины |
| Ароматические кислоты | Эфиры |
Знание силы кислоты позволяет органическим химикам предсказывать, как будут протекать химические реакции и регулировать условия проведения этих реакций. Это важно для синтеза органических соединений, разработки новых лекарств, изучения механизмов реакций и других областей органической химии.








