Постоянная степень окисления - это одна из основных концепций в химии, которая помогает описать и предсказать реакции веществ. Как известно, атомы могут получать или отдавать электроны во время химических реакций. Постоянная степень окисления указывает на число электронов, которое переходит от одного атома к другому.
Определение постоянной степени окисления важно для понимания, какие атомы окисляются (теряют электроны) и какие атомы восстанавливаются (получают электроны) в химической реакции. Постоянная степень окисления позволяет определить, какие элементы являются окислителями, а какие - восстановителями.
Один из способов определить постоянную степень окисления это использование электрохимических методов. Например, величина стандартного окислительно-восстановительного потенциала (ЭОВП) может быть использована для определения постоянной степени окисления атомов в веществе.
Примеры постоянной степени окисления могут включать различные элементы и их соединения. Например, в воде (H2O) кислород имеет постоянную степень окисления -2, в то время как водород имеет постоянную степень окисления +1. В перекиси водорода (H2O2) кислород имеет постоянную степень окисления -1, а водород - +1.
Что такое постоянная степень окисления?

Постоянная степень окисления (ПСО) представляет собой число, которое указывает на изменение заряда атома при его участии в химической реакции. Она описывает, сколько электронов атом получает или отдает в процессе реакции.
ПСО позволяет определить количество электронов, которые переходят от одного вещества к другому в процессе окислительно-восстановительной реакции. Это важно для понимания механизма химических превращений и определения структуры соединений.
Величина постоянной степени окисления вещества может быть положительной, отрицательной или равной нулю. Положительное значение ПСО указывает на окислительные свойства вещества, отрицательное - на его восстановительные свойства, а нулевое значение означает, что атом не получает и не отдает электроны.
Часто постоянная степень окисления используется для назначения ионов и соединений, а также для балансирования химических уравнений. На основе ПСО можно определить, какие вещества окисляются, а какие восстанавливаются в процессе реакции.
Примеры веществ с постоянной степенью окисления: Na+ (постоянная степень окисления +1), Cl- (постоянная степень окисления -1), O2- (постоянная степень окисления -2), H+ (постоянная степень окисления +1).
Факторы, влияющие на постоянную степень окисления
Постоянная степень окисления элемента зависит от нескольких факторов:
1. Электроотрицательность элемента. Чем больше электроотрицательность элемента, тем выше его постоянная степень окисления. Например, кислород имеет высокую электроотрицательность, поэтому его постоянная степень окисления в соединениях обычно равна -2.
2. Расположение элемента в периодической системе. Положение элемента в периодической системе также влияет на его постоянную степень окисления. Например, металлы в основном имеют положительную степень окисления, а неметаллы - отрицательную. Однако, существуют исключения, например, в соединениях переходных металлов они могут иметь различные степени окисления.
3. Структура соединения. В структуре соединения может быть учтена постоянная степень окисления элементов. Например, в некоторых соединениях кислорода его степень окисления может быть равной -1, в то время как в других -2.
4. Ионизационный потенциал. Ионизационный потенциал элемента может влиять на его степень окисления. Высокий ионизационный потенциал может указывать на низкую постоянную степень окисления, а низкий - на высокую степень окисления.
5. Валентность элемента. Валентность элемента, то есть количество связей, которые он способен образовать, также может играть роль в определении постоянной степени окисления. Например, у элемента с валентностью 1 его постоянная степень окисления будет равна +1.
Все эти факторы могут влиять на постоянную степень окисления элементов и помогают определить ее в различных соединениях.
Примеры веществ с постоянной степенью окисления
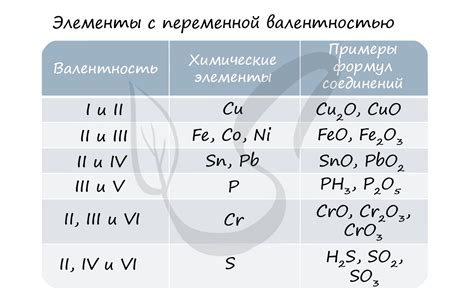
Существует множество веществ, у которых степень окисления атомов остается постоянной в различных соединениях. Некоторые из них включают:
1. Хлорид натрия (NaCl): В этом соединении натрий имеет всегда +1 степень окисления, а хлор -1. Натрий всегда отдает один электрон хлору при образовании хлорида.
2. Оксид магния (MgO): В оксиде магния магний всегда имеет +2 степень окисления, а кислород -2. Магний отдает два электрона кислороду при образовании соединения.
3. Гидроксид аммония (NH4OH): В этом соединении аммоний имеет всегда +1 степень окисления, а кислород -2. Аммоний отдает один электрон кислороду и один электрон водороду при образовании гидроксида аммония.
4. Сульфат меди (CuSO4): В сульфате меди медь всегда имеет +2 степень окисления, а сера +6. Медь отдает два электрона сере при образовании соединения.
Эти примеры демонстрируют, что степень окисления атомов в этих веществах остается постоянной, независимо от других элементов, с которыми они соединяются.
Практическое применение постоянной степени окисления
Практическое применение постоянной степени окисления имеет важное значение во многих областях химии, включая аналитическую химию, неорганическую химию, физическую химию и органическую химию.
Вот некоторые примеры практического применения постоянной степени окисления:
1. Анализ и идентификация соединений.
Постоянная степень окисления позволяет определить кислотность или щелочность вещества, что является важным фактором при анализе химических соединений. Она также может помочь в идентификации и классификации соединений.
2. Расчет ионных соединений.
Зная постоянную степень окисления элемента в соединении, можно рассчитать количество ионов, с учетом их заряда. Это особенно важно при составлении уравнений реакций и химических расчетах.
3. Определение величины окислительно-восстановительного потенциала.
Постоянная степень окисления используется для определения окислительно-восстановительного потенциала химических соединений. Это полезно при изучении электрохимических реакций и процессов, связанных с производством электричества.
4. Квантово-химические расчеты.
В квантово-химических расчетах постоянная степень окисления используется для описания электронной структуры исследуемых молекул, а также для определения их химических свойств и реакционной способности.
В целом, понимание и использование постоянной степени окисления имеет большое значение для различных областей химии и позволяет углубить наше понимание поведения и свойств веществ.








