Химические элементы - это вещества, которые нельзя разложить на более простые вещества обычными химическими методами. Существует огромное множество различных химических элементов, поэтому их необходимо классифицировать для удобства изучения и организации информации.
Подгруппа химических элементов - это группа элементов, которые имеют сходные характеристики и основаны на их электронной конфигурации. Каждая подгруппа четко определена и имеет свои химические свойства. Например, галогены - это подгруппа элементов, наиболее характерной особенностью которой является наличие семь электронов во внешнем энергетическом уровне.
Классификация подгрупп химических элементов основана на их положении в таблице Менделеева. Таблица Менделеева разбита на ряды и группы, а подгруппы находятся внутри групп. Подгруппы могут быть идентифицированы по букве, обозначающей элемент с наибольшим атомным номером. Например, в группе алкалитов, подгруппа организована вокруг элемента с атомным номером 3 - лития.
Понятие "подгруппа химических элементов"

Классификация подгрупп химических элементов основана на общей электронной конфигурации элементов (количество электронов во внешней энергетической оболочке). Благодаря сходству своих электронных структур, элементы одной подгруппы обладают схожими химическими свойствами и образуют аналогичные типы химических соединений.
Таблица Менделеева состоит из 18 вертикальных столбцов, которые обозначаются как группы или периоды. Подгруппы химических элементов обозначаются числами от 1 до 18 и обычно разделяются на несколько основных категорий:
| Подгруппа | Обозначение | Химические элементы |
| 1 | IA | Литий (Li), Натрий (Na), Калий (K), Рубидий (Rb), Цезий (Cs), Франций (Fr) |
| 2 | IIA | Бериллий (Be), Магний (Mg), Кальций (Ca), Стронций (Sr), Барий (Ba), Радий (Ra) |
| 3-12 | BC (Bотические металлы) или Переходные металлы | Скандий (Sc), Титан (Ti), Ванадий (V), Хром (Cr), Марганец (Mn), Железо (Fe), Кобальт (Co), Никель (Ni), Медь (Cu), Цинк (Zn), Сурьма (Ga), Германий (Ge), Мышьяк (As), Селен (Se), Бром (Br), Криптон (Kr) |
Это лишь небольшой пример различных подгрупп химических элементов в таблице Менделеева. Каждая подгруппа имеет свое уникальное обозначение и состоит из ряда химических элементов с сходными химическими свойствами.
Определение и основные характеристики
Подгруппа химических элементов представляет собой категорию элементов, которые имеют некоторые общие химические свойства. Главным образом, эти элементы имеют сходную электронную конфигурацию и химическое поведение.
Одним из важных признаков подгруппы является номер группы, которому принадлежит элемент. В периодической системе Менделеева группы элементов вертикально располагаются от 1 до 18, и каждая группа имеет свою особую химическую природу. Таким образом, элементы в одной группе обладают сходными свойствами и реакционной способностью.
Элементы в подгруппе также могут иметь схожие физические свойства, такие как плотность, точка плавления и кипения, атомный радиус и электроотрицательность. Это делает классификацию элементов удобной в научных и практических целях.
Обычно подгруппы элементов обозначаются римскими цифрами от I до VIII, где каждая цифра соответствует конкретной подгруппе. Это помогает визуально и легко ориентироваться в периодической системе Менделеева и понимать связь между элементами.
Знание о подгруппах элементов является важной основой химических наук, таких как органическая и неорганическая химия, физическая химия и биохимия. Изучение и понимание подгрупп элементов позволяет предсказывать и объяснять химические реакции, свойства соединений и строение вещества, что имеет практическое применение в различных отраслях науки и технологии.
Роль и значение подгрупп в периодической системе элементов
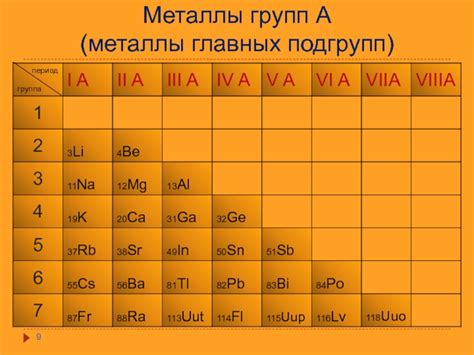
Подгруппы являются составной частью групп элементов и помогают более детально классифицировать их. Каждая подгруппа имеет свои особенности и значения.
В ПСЭ элементы в подгруппе обладают схожими химическими свойствами. Например, первая подгруппа группы 1 (символы 1A и 1B) состоит из щелочных металлов - веществ, обладающих высокой реактивностью и способных легко образовывать ионы положительного заряда. Вторая подгруппа группы 2 (символы 2A и 2B) состоит из щелочноземельных металлов - элементов, химические свойства которых схожи с щелочными металлами, но они менее реактивны.
Помимо классификации элементов по химическим свойствам, подгруппы также имеют значение при определении электронной конфигурации и расположении элементов в ПСЭ. Они помогают упростить и организовать систему и позволяют легко определять связанные элементы и их свойства.
Также стоит отметить, что подгруппы не включают все элементы, а только те, которые подчиняются общим закономерностям и имеют сходные свойства. Это помогает упростить ПСЭ и делает его более удобным инструментом для изучения и понимания свойств элементов.
В итоге, подгруппы в периодической системе элементов играют важную роль в классификации элементов и позволяют упростить их изучение и понимание. Они помогают нам лучше понять закономерности и свойства элементов, а также дать систематическое представление о химической реактивности и взаимодействии веществ.
Классификация подгрупп химических элементов
Подгруппа химических элементов - это группа элементов, которые имеют общие химические свойства и химические реакции. Подгруппы часто определяются их электронной конфигурацией, что указывает на основные характеристики элементов внутри подгруппы.
Существует несколько основных подгрупп элементов, включая щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, металлоиды, неметаллы и благородные газы.
Щелочные металлы: щелочные металлы находятся в первой группе таблицы элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Рb), цезий (Cs) и франций (Fr). Эти элементы характеризуются низкой плотностью, низкой температурой плавления и высокой реакционной способностью.
Щелочноземельные металлы: щелочноземельные металлы находятся во второй группе таблицы элементов. Они включают бериллий (Be), магний (Mg), кальций (Сa), стронций (Sr), барий (Ва) и радий (Ra). Эти элементы обладают высокой плотностью, высокой температурой плавления и относительно высокой реакционной способностью.
Переходные металлы: переходные металлы находятся в блоках d и f таблицы элементов. Они включают металлы, начиная с титана (Тi) и заканчивая оловем (Sn) в блоке d, а также лантан (La) и лутеций (Lu) в блоке f. Эти элементы обладают типичными металлическими свойствами и могут иметь различные окислительные состояния.
Постпереходные металлы: постпереходные металлы находятся между блоками s и d таблицы элементов. Они включают алюминий (Al), цинк (Zn), галлий (Ga), индий (In), олово (Sn), свинец (Pb) и их смежные элементы. Они обладают свойствами, характерными как для металлов, так и для неметаллов.
Металлоиды: металлоиды находятся между металлами и неметаллами в таблице элементов. Они включают бор (B), кремний (Si), германий (Ge), арсений (As), селен (Se) и теллур (Te). Металлоиды обладают свойствами как металлов, так и неметаллов, в зависимости от условий.
Неметаллы: неметаллы находятся в правой части таблицы элементов. Они включают водород (Н), углерод (C), кислород (O), азот (N), фосфор (P), серу (S) и другие элементы. Неметаллы обладают низкой электропроводностью и обычно образуют отрицательные ионы при реакциях.
Благородные газы: благородные газы находятся в последней группе таблицы элементов. Они включают гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Благородные газы имеют низкую реакционную способность и заполняют пустоты в реакционных системах.
Таким образом, классификация подгрупп химических элементов позволяет обозначить и структурировать различные категории элементов на основе их общих химических свойств и электронной конфигурации.
Типы подгрупп: s, p, d, f
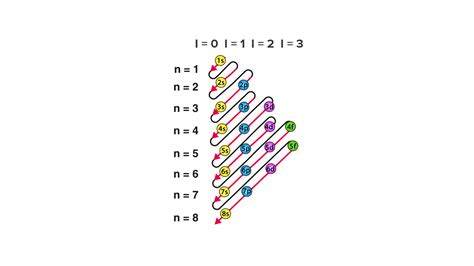
Подгруппы химических элементов классифицируются на основе их электронной конфигурации и места в периодической таблице. Всего существует четыре типа подгрупп: s, p, d, f.
Подгруппа s представляет собой элементы, у которых последний электрон находится в s-орбитале. В периодической таблице они располагаются в левой части и обозначены цифрой 1 или 2.
Подгруппа p состоит из элементов, у которых последний электрон находится в p-орбитале. В таблице они находятся в правой части главных групп и обозначаются цифрами 13-18.
Подгруппа d относится к элементам, у которых последний электрон находится в d-орбитале. Они расположены в таблице между s- и p-подгруппами и имеют числовые обозначения от 3 до 12.
Подгруппа f представляет элементы, у которых последний электрон находится в f-орбитале. Они находятся под таблицей основных подгрупп и имеют обозначения от 57 до 71 и от 89 до 103.
Каждая подгруппа химических элементов имеет свои уникальные свойства и играет важную роль в различных химических реакциях и соединениях.
Химические свойства элементов каждой подгруппы
Каждая подгруппа химических элементов имеет свои характерные химические свойства.
1. Алкалии (1 группа)
Элементы первой группы, известные как алкалии, обладают следующими химическими свойствами:
- Они обладают высокой реактивностью и сильной щелочностью.
- Алкалии образуют стабильные и растворимые гидроксиды, которые являются сильными щелочами.
- Элементы этой подгруппы легко окисляются воздухом и реагируют с водой, выделяя водород.
- Алкалии образуют стабильные соли.
2. Землеалкaлии (2 группа)
Элементы второй группы, известные как землеалкалии, также имеют свои характерные химические свойства:
- Эти элементы реагируют с водой, но менее активно по сравнению с алкалями.
- Землеалкалии образуют менее щелочные гидроксиды в сравнении с алкалями.
- Они образуют стабильные соли с хлоридами, нитратами и другими кислотами.
3. Полупроводниковые элементы (13-17 группа)
Элементы, находящиеся в диапазоне от третьей до седьмой подгруппы, известны как полупроводники. Они обладают следующими химическими свойствами:
- Они обладают свойствами как металлов, так и неметаллов.
- Полупроводники обычно образуют ковалентные соединения, но также могут образовывать и ионные соединения.
- У них широкий диапазон электропроводности.
4. Галогены (17 группа)
Элементы семнадцатой группы, известные как галогены, обладают следующими химическими свойствами:
- Они образуют ковалентные соединения с другими элементами.
- Галогены имеют высокую электроотрицательность.
- Они реагируют с металлами, образуя соли.
- Галогены образуют такие химические соединения, как галогеноводороды и галогениды.
5. Благородные газы (18 группа)
Благородные газы, также известные как инертные газы, являются наиболее неподвижными элементами. Они имеют следующие химические свойства:
- Благородные газы практически не образуют химические соединения с другими элементами.
- Эти элементы хорошо изолируют электричество и не горят.
Знание химических свойств элементов каждой подгруппы помогает понять их поведение в химических реакциях и их важность в различных индустриях и научных исследованиях.








