Ковалентная связь - это тип химической связи, который образуется между атомами, когда они делят свои электроны. В отличие от ионной связи, где один атом отдает электрон другому, при ковалентной связи электроны общие и принадлежат обоим атомам. Этот тип связи может образовываться между атомами одного элемента или разных элементов.
Ковалентная связь является одним из ключевых понятий в химии. Она объясняет, как атомы образуют молекулы и влияют на их свойства. Ковалентные связи могут быть одиночными, двойными или тройными, в зависимости от того, сколько пар электронов общих атомов включены в связи.
Примером ковалентной связи является водородная молекула, состоящая из двух атомов водорода, которые образуют связь, делая общий электронный облако вокруг себя. Ковалентная связь также образуется в молекуле кислорода, состоящей из двух атомов кислорода, и в многих других органических и неорганических соединениях.
Ковалентная связь обеспечивает стабильность молекул и определяет их физические и химические свойства. Она также играет важную роль в реакциях обмена электронами, которые происходят между молекулами и в реакциях разрушения молекул. Понимание ковалентной связи помогает ученым разрабатывать новые вещества и лекарства, а также понимать и предсказывать химические реакции.
Ковалентная связь: основные понятия и примеры
Основные понятия, связанные с ковалентной связью:
- Электронная пара: общая пара электронов, которые участвуют в формировании ковалентной связи между двумя атомами.
- Электронная оболочка: ковалентная связь осуществляется путем обмена электронами из внешней оболочки одного атома со свободными местами внешней оболочки другого атома.
- Октетное правило: большинство атомов стремятся иметь внешнюю оболочку с 8 электронами - это называется октетным правилом. Атомы деляют электроны, чтобы достичь этого стабильного состояния.
Примеры ковалентных связей:
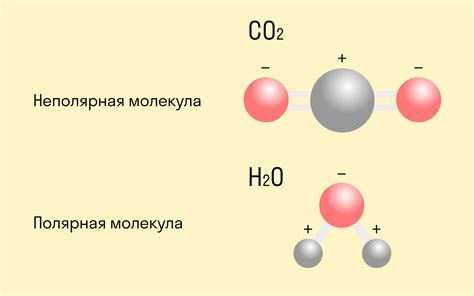
- Молекула воды (H2O): вода состоит из двух атомов водорода и одного атома кислорода, связанных ковалентными связями. В этой молекуле кислород делит электроны со связанными водородом атомами, образуя две электронные пары.
- Молекула метана (CH4): метан состоит из одного атома углерода и четырех атомов водорода, связанных ковалентными связями. Углерод делит электроны со связанными атомами водорода, образуя четыре электронные пары.
- Молекула аммиака (NH3): аммиак состоит из одного атома азота и трех атомов водорода, связанных ковалентными связями. Азот делит электроны со связанными атомами водорода, образуя три электронные пары.
Ковалентные связи играют важную роль в химии и химических реакциях. Они создают структуру и стабильность в молекулах и обеспечивают возможность образования сложных химических соединений.
Определение и характеристики ковалентной связи
При ковалентной связи электроны, находящиеся в валентной оболочке атомов, способны образовывать общие электронные пары, также известные как ковалентные пары. Электроны в ковалентной связи притягиваются к ядрам обоих атомов и образуют силу притяжения, которая удерживает атомы вместе в молекуле.
Ковалентная связь образуется между неметаллическими элементами или между атомами одного элемента. Этот тип связи обычно характеризуется силой связи, которая зависит от разности электроотрицательности атомов. Чем больше разность электроотрицательности между атомами, тем сильнее будет ковалентная связь.
Ковалентная связь может быть полярной или неполярной в зависимости от того, как распределены электроны между атомами. В полярной ковалентной связи электроны смещены ближе к одному атому, что создает частичные заряды в молекуле. В неполярной ковалентной связи электроны равномерно распределены между атомами и молекула не имеет зарядов.
- Ковалентная связь характерна для большинства органических соединений, таких как углеводороды и аминокислоты.
- Примеры ковалентных связей включают связь между атомами водорода в молекуле воды (H2O) и связь между атомами углерода и атомами водорода в метане (CH4).
- Ковалентная связь может быть одиночной, двойной или тройной. В одиночной связи общается одна пара электронов, в двойной – две пары, а в тройной – три пары.
Примеры ковалентных связей
Ковалентная связь наиболее распространена в химии и может образовываться между атомами различных элементов. Вот несколько примеров:
1. Молекула воды (H2O) образуется путем обмена электронами между атомами водорода и атомом кислорода. Каждый атом водорода делит свои электроны с атомом кислорода, образуя пару общих электронов. В результате этих общих электронных пар между атомами образуется ковалентная связь.
2. Этилен (C2H4) - это газообразное вещество, состоящее из двух атомов углерода и четырех атомов водорода. В молекуле этилена каждый углерод делит два своих электрона с соседним углеродом и одним атомом водорода. Это образует две двойные ковалентные связи между углеродными атомами и одинарную ковалентную связь между углеродным атомом и каждым атомом водорода.
3. Молекула метана (CH4) состоит из одного атома углерода и четырех атомов водорода. Каждый атом водорода делит свои электроны с атомом углерода, образуя одинарную ковалентную связь. В результате четырех общих электронных пар между углеродным атомом и атомами водорода образуется ковалентная связь.
4. Молекула аммиака (NH3) состоит из одного атома азота и трех атомов водорода. Каждый атом водорода делит свои электроны с атомом азота, образуя одинарную ковалентную связь. В результате трех общих электронных пар между атомом азота и атомами водорода образуется ковалентная связь.
Ковалентная связь в органической химии
Ковалентная связь в органической химии образуется, когда одна пара электронов делится между двумя атомами. Все электроны волоконного типа образуют электронные облака, которые окружают ядро атомов. Электроны могут образовывать связи с другими атомами, образуя так называемые связные попарные электроны.
Ковалентные связи в органической химии могут быть одинарными, двойными или тройными. В одиночной ковалентной связи пара электронов делится между двумя атомами. В двойной ковалентной связи две пары электронов делятся между двумя атомами. В тройной ковалентной связи три пары электронов делятся между двумя атомами.
В органической химии, ковалентные связи между атомами углерода и другими атомами создают основу для разнообразных органических соединений, таких как углеводороды, алканы, алкены, алкины, спирты, амины, карбоновые кислоты и другие. Ковалентная связь позволяет молекулам соединяться в более сложные структуры, образуя полимеры, сетки, кольца и другие формы органических соединений.
Примерами органических соединений, образованных ковалентными связями, являются метан (CH4), этан (C2H6), этилен (C2H4), ацетилен (C2H2), метанол (CH3OH), этанол (C2H5OH) и другие.
Ковалентная связь в неорганической химии
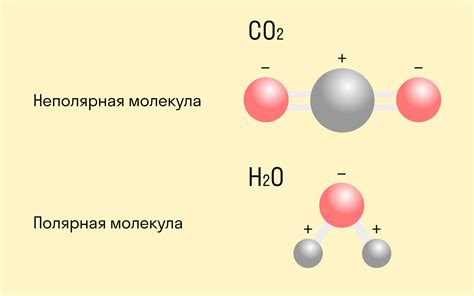
Для образования ковалентной связи атомы должны разделить свои электроны, чтобы общее количество электронов в молекуле оставалось неизменным. При этом каждый атом становится более стабильным за счет образования полностью заполненной внешней оболочки электронов.
Примером ковалентной связи в неорганической химии может служить молекула воды (H2O). В ней каждый атом водорода обменивает один электрон с атомом кислорода, что позволяет обоим атомам образовать полностью заполненные внешние оболочки.
В неорганической химии ковалентные связи могут образовываться не только между атомами одного элемента, но и между атомами разных элементов. Такие соединения называются бинарными или многоатомными неорганическими соединениями.
Ковалентная связь в неорганической химии имеет ряд особенностей и может принимать различные формы, включая одинарные, двойные и тройные связи. Она является характерной особенностью неорганических соединений и играет важную роль во многих процессах и реакциях, определяя их физические и химические свойства.








