Константа кислотности является важным понятием в химии и физике. Она представляет собой величину, которая определяет степень ионизации кислоты в растворе. Константу кислотности обозначают как Ка и она может быть различной для разных кислот.
Константа кислотности определяется как отношение концентрации ионов водорода (H+) и концентрации недиссоциированных кислотных молекул в растворе. Именно эта величина позволяет оценить, насколько кислота легко отдает протон в растворе, а также определить ее кислотность.
Константа кислотности может быть выражена с помощью различных величин, таких как pH или pKa. pH - это отрицательный логарифм концентрации ионов водорода в растворе. Он является основным индикатором кислотности или щелочности вещества. Кроме того, pKa - это логарифмическая форма константы кислотности, которая позволяет сравнивать кислоты между собой.
Знание константы кислотности и ее определение являются необходимыми в химических расчетах и позволяют понять особенности кислотно-щелочных реакций.
Таким образом, константа кислотности является ключевым понятием в химии и позволяет определить кислотность вещества в растворе. Ее определение и использование широко применяются в научных и прикладных исследованиях, а также в различных отраслях промышленности.
Значение и определение константы кислотности

Математически константа кислотности выражается следующим уравнением:
Ka = [H+][A-]/[HA]
Значение константы кислотности может быть использовано для определения, насколько сильным кислотным характером обладает определенная молекула или раствор. Чем больше значение Ka, тем сильнее кислота.
Для удобства использования, значения константы кислотности обычно выражаются в логарифмической форме, известной как pKa. Константа кислотности и ее логарифмическая форма позволяют ученым и химикам анализировать и сравнивать силу кислотности различных веществ и растворов.
Роль константы кислотности в химических реакциях
Константа кислотности определяется концентрацией ионов водорода (H+) в растворе. Вода может диссоциировать, образуя ионы H+ и OH-. Концентрация ионов H+ в растворе влияет на протекание реакций, а значит, на химическое равновесие системы.
Константа кислотности выражается через логарифмическую шкалу pH, где pH = -log[H+]. Чем ниже значение pH, тем более кислотным считается раствор, а чем выше значение pH, тем более щелочным он является. Нейтральным считается раствор с pH равным 7.
Роль константы кислотности в химических реакциях состоит в следующем:
- Определение степени протекания реакций: чем меньше значение pH, тем больше концентрация ионов H+ в растворе, что способствует протеканию реакций, связанных с ионами водорода.
- Регуляция скорости реакций: константа кислотности влияет на эффективность катализаторов и промежуточных комплексов, влияя на скорость химических реакций.
- Определение химического равновесия: константа кислотности определяет направленность реакций и распределение веществ в системе, влияет на смещение равновесия и степень завершенности реакций.
- Установление оптимальных условий для проведения реакций: знание константы кислотности позволяет контролировать и корректировать pH реакционной среды для достижения наилучшего результата.
Таким образом, константа кислотности является важной характеристикой химических реакций, позволяющей определить степень кислотности или щелочности раствора, влияющую на протекание и направленность реакций, скорость реакций, химическое равновесие и оптимальные условия проведения реакций.
Методы определения константы кислотности

Существует несколько методов, с помощью которых можно определить константу кислотности:
- Метод pH-метрии: в данном методе используется pH-метр для измерения концентрации ионов водорода в растворе. По значению pH можно вычислить константу кислотности.
- Метод электрометрии: данный метод основан на измерении разности потенциалов между электродами различного состава, погруженными в раствор. Измерения позволяют определить константу кислотности.
- Метод рентгеноструктурного анализа: этот метод позволяет изучать структуру атомов и молекул вещества, включая межатомные расстояния и углы, что позволяет определить константу кислотности.
- Метод спектроскопии: данный метод использует анализ спектров излучения, поглощаемого или испускаемого веществом. По характеристикам спектра можно определить константу кислотности.
Каждый из этих методов имеет свои преимущества и недостатки и применяется в зависимости от типа и свойств исследуемых веществ и условий эксперимента.
Факторы, влияющие на значение константы кислотности
- Структура кислоты: Молекулярная структура кислоты может сильно влиять на ее константу кислотности. Например, карбоновые кислоты, содержащие электронных-притягивающие группы, обычно имеют более низкие значения pKa, что указывает на более сильную кислотность.
- Среда раствора: Константа кислотности также зависит от растворителя, в котором происходит диссоциация кислоты. Водный раствор обычно используется для измерения pKa многих соединений, однако у других растворителей могут быть различные эффекты на значение константы кислотности.
- Температура: Значение константы кислотности может меняться с изменением температуры. Обычно константа кислотности увеличивается при повышении температуры, что свидетельствует о более сильной кислотности при более высоких температурах.
- Растворимость: Растворимость кислоты в растворе также может влиять на значение константы кислотности. Если концентрация диссоциированной кислоты в растворе сильно превышает начальную концентрацию недиссоциированной кислоты, значение pKa будет низким, что указывает на более сильную кислотность.
- Тиглотеоретическое значение: Некоторые соединения, такие как амины, могут образовывать ионы с различными степенями диссоциации, что приводит к нескольким значениям pKa. Это связано с наличием нескольких активных мест в молекуле, способных диссоциировать.
Учет этих факторов важен для понимания поведения кислот и щелочей и их реакций в различных условиях. Знание константы кислотности позволяет прогнозировать направление и силу химических реакций, а также выбирать оптимальные условия для проведения экспериментов и промышленных процессов.
Значение константы кислотности в окружающей среде

Значение константы кислотности находится в диапазоне от 0 до 14. Если pH менее 7, это указывает на кислотную среду, более 7 – на щелочную, а при pH 7 – на нейтральную среду.
Значение константы кислотности в окружающей среде может меняться в зависимости от различных факторов. Например, естественное окружение, такое как почвы и водные ресурсы, могут иметь различные уровни кислотности в зависимости от состава грунта, географического расположения и других факторов.
Воздействие антропогенной деятельности также оказывает влияние на значение константы кислотности в окружающей среде. Например, промышленные выбросы, загрязнение водоемов отходами и кислотные дожди могут значительно повлиять на pH окружающей среды.
Знание значения константы кислотности в окружающей среде является важным фактором для понимания ее состояния и воздействия на живые организмы. Это помогает определить, какие условия являются оптимальными для различных видов растений, животных и микроорганизмов, а также снижает риск потенциального воздействия на окружающую среду.
Константа кислотности и pH
Константа кислотности зависит от вещества, взаимодействующего с растворителем. Для кислоты это выражается следующим образом:
- Если Ka больше 1, то кислота является сильной и полностью ионизируется в растворе.
- Если Ka меньше 1, то кислота является слабой и лишь частично ионизируется в растворе.
Концентрация ионов водорода в растворе можно выразить через pH-значение, которое определяется по формуле pH = -log[H+]. Чем меньше значение pH, тем более кислотной считается среда. Например, при pH ниже 7 раствор считается кислотным, при pH выше 7 – щелочным, а pH 7 соответствует нейтральной среде.
Константа кислотности и pH имеют важное значение в различных областях химии и биологии. Они позволяют определить кислотность или щелочность различных растворов, а также контролировать оптимальные условия для различных жизненных процессов.
Применение константы кислотности в различных науках и отраслях

Химия: Константа кислотности широко используется в химических исследованиях для оценки кислотности или щелочности растворов. Она позволяет определить, насколько раствор является кислотным (низкое значение pH), щелочным (высокое значение pH) или нейтральным (среднее значение pH). Константа кислотности используется для контроля pH в бассейнах, аквариумах, а также при производстве пищевых продуктов.
Медицина: В медицине константа кислотности играет важную роль при диагностике различных заболеваний. Например, изменения pH крови могут указывать на нарушение гомеостаза организма, что является симптомом некоторых заболеваний. Константа кислотности также используется в фармацевтической индустрии для разработки лекарственных препаратов и исследований их воздействия на организм.
Экология: Константа кислотности имеет значение в экологических исследованиях, особенно при изучении влияния кислотности на водные экосистемы. Например, изменение pH водных ресурсов может негативно влиять на жизнь водных организмов и биологическое разнообразие. Понимание константы кислотности позволяет ученым оценить влияние различных факторов на окружающую среду и принять меры для ее защиты.
Полевая геология: Некоторые геологические процессы могут изменять pH почвы и водных ресурсов. Знание константы кислотности позволяет геологам исследовать такие изменения и оценить их влияние на природную среду. Это важно для определения оптимальных условий для сельского хозяйства, а также для оценки рисков загрязнения почвы и воды различными химическими веществами.
Все эти примеры демонстрируют разнообразное применение константы кислотности в различных науках и отраслях. Она является важным инструментом, который помогает ученым и специалистам контролировать и изучать окружающую среду, заболевания и химические процессы.
Примеры константы кислотности различных веществ
Соляная кислота (HCl): Константа кислотности соляной кислоты составляет около -6,3. Это говорит о том, что соляная кислота является очень сильной кислотой и полностью диссоциирует в воде.
Уксусная кислота (CH3COOH): Константа кислотности уксусной кислоты составляет около 4,8. Это говорит о том, что уксусная кислота является слабой кислотой, которая лишь частично диссоциирует в воде.
Аммиак (NH3): Константа кислотности аммиака составляет около 9,2. Это говорит о том, что аммиак является слабой основой, которая лишь частично принимает протоны.
Вода (H2O): Константа кислотности воды составляет около 14. Это говорит о том, что вода может действовать как кислота и основание и полностью диссоциирует в ионный вид.
Знание константы кислотности позволяет предсказывать поведение веществ в различных условиях и играет важную роль в химических реакциях и процессах.
Изменение константы кислотности в зависимости от условий
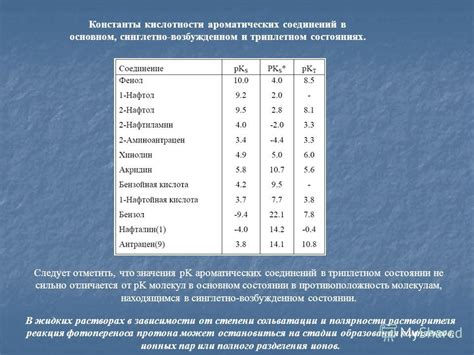
Константа кислотности может меняться в зависимости от различных условий, таких как температура, давление, концентрация ионов. Например, при повышении температуры раствора происходит увеличение активности ионов водорода, что приводит к уменьшению значения pH и увеличению кислотности.
Также константа кислотности может изменяться при изменении концентрации ионов. Если в растворе присутствуют более концентрированные ионы водорода, то значение pH будет ниже и кислотность будет выше. Наоборот, если концентрация ионов водорода уменьшается, то значение pH возрастает, и раствор становится более щелочным.
При изменении давления также может наблюдаться изменение константы кислотности. В случае реакции, в которой включены газовые компоненты, изменение давления может повлиять на равновесие реакции и, следовательно, на константу кислотности.
Изменение константы кислотности играет важную роль в различных химических и биологических процессах, таких как растворение минералов, реакции в желудочно-кишечном тракте и важные биохимические реакции в организме.








