Компоненты реакции - это вещества, участвующие в химической реакции и претерпевающие изменения. Они являются ключевыми элементами, определяющими характер и исход реакции. Наличие и соотношение компонентов реакции являются основными факторами, влияющими на скорость и направление химического процесса.
Компоненты реакции могут быть разделены на две основные категории: реагенты и продукты. Реагенты - это исходные вещества, которые претерпевают химические изменения. Они обычно обозначаются слева от стрелки, указывающей направление реакции. Продукты - это новые вещества, образующиеся в результате химической реакции. Они обычно обозначаются справа от стрелки.
Компоненты реакции имеют важное значение в химии, так как они позволяют установить стехиометрические соотношения между веществами. Стехиометрия - это область химии, изучающая количественные отношения между реагирующими веществами и продуктами реакции. Знание компонентов реакции и их соотношений позволяет установить, сколько вещества необходимо для получения определенного количества продукта реакции и наоборот. Это особенно важно при планировании и проведении химических синтезов и анализе веществ.
Важно отметить, что в химии могут быть различные типы компонентов реакции: элементы, соединения, ионы и реакционные молекулы. Каждый из них обладает своими свойствами и характеристиками, влияющими на процесс исследования и понимание химических реакций.
Таким образом, компоненты реакции являются основными строительными блоками в мире химии. Их понимание и анализ позволяют исследователям и ученым получать новые знания о взаимодействии веществ и совершенствовать технологии в области синтеза и анализа. Благодаря этому, химия играет важную роль в промышленности, медицине, энергетике и других областях нашей жизни.
Реакция в химии: сущность и процесс
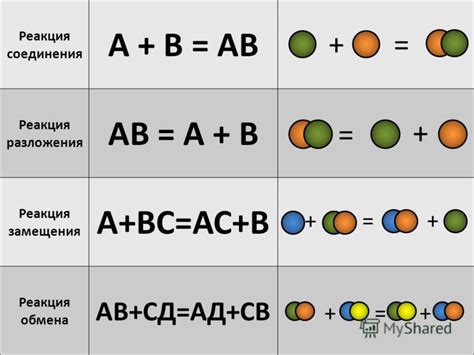
Реакция в химии представляет собой особый процесс превращения одних химических веществ в другие. Она характеризуется изменениями в структуре и составе атомов, молекул и ионов.
| Составляющие реакции | Описание |
|---|---|
| Реагенты | Исходные вещества, которые участвуют в химической реакции. Они могут быть представлены атомами, молекулами или ионами. |
| Продукты | Вещества, полученные в результате химической реакции. Они образуются из реагентов путем перераспределения атомов, молекул и ионов. |
| Коэффициенты | Числа, указывающие, в каком соотношении должны находиться реагенты и продукты химической реакции. Они записываются перед формулой вещества. |
| Уравнение реакции | Выражение, описывающее баланс между реагентами и продуктами химической реакции с помощью химических формул и коэффициентов. |
Реакции в химии могут протекать с различной скоростью и при разных условиях. Они могут быть экзотермическими, освобождающими энергию, или эндотермическими, поглощающими энергию. Кроме того, реакции могут быть обратимыми и необратимыми, в зависимости от того, можно ли восстановить исходные вещества из продуктов.
Понимание реакций и их компонентов является ключевым элементом в изучении химии. Оно позволяет предсказывать результаты химических превращений, оптимизировать процессы синтеза веществ, а также разрабатывать новые соединения и материалы.
Компоненты реакции: основные элементы
1. Реагенты – это вещества, которые участвуют в реакции и превращаются в другие вещества. Реагенты записываются слева от знака "->" (стрелка) и разделяются плюсами. Например, для реакции горения метана (CH4) в кислороде (O2), реагенты можно записать следующим образом: CH4 + O2.
2. Продукты – это вещества, которые образуются в результате химической реакции. Продукты записываются справа от знака "->" (стрелка) и также разделяются плюсами. В указанной реакции горения метана (CH4) в кислороде (O2), продуктами будут вода (H2O) и углекислый газ (CO2): CH4 + O2 -> H2O + CO2.
3. Коэффициенты – это числа, которые показывают, в каком соотношении участвуют реагенты и продукты в реакции. Коэффициенты записываются перед формулами веществ и позволяют соблюдать принцип сохранения массы во время реакции. Например, в реакции горения метана (CH4) в кислороде (O2) можно использовать коэффициенты 1 перед обоими веществами, чтобы соблюсти принцип сохранения массы: CH4 + 2O2 -> 2H2O + CO2.
Знание компонентов реакции и их значений позволяет ученым анализировать и предсказывать химические превращения, а также осуществлять балансировку химических уравнений. Понимание этих компонентов является важным для изучения химии и ее применения в различных областях науки и технологии.
Реагенты: роль и значение в химической реакции
Роль реагентов в химической реакции заключается в том, что они обеспечивают необходимые исходные материалы для образования новых веществ. Каждый реагент вносит свой вклад в происходящую реакцию, и его химические свойства определяют конечный продукт реакции.
Значение реагентов в химии невозможно переоценить. Они играют ключевую роль в химических превращениях, позволяют синтезировать новые вещества и создавать различные продукты. Без реагентов химические реакции не могли бы происходить, и многие важные открытия в области химии не были бы возможны.
Реагенты могут быть использованы в различных химических реакциях, включая синтез органических соединений, окислительно-восстановительные реакции, нейтрализацию, гидролиз и многое другое. Использование правильных реагентов и их соотношений является важным аспектом успешной реакции и получения желаемого продукта.
Иногда реагенты могут быть определены как исходные вещества, которые изменяются в процессе реакции, в то время как продукты реакции - это полученные в результате реакции новые вещества.
Реагенты могут быть представлены в виде таблицы или списка, где указывается их название, химическая формула или структура, а также их количество, необходимое для проведения реакции. Правильное использование и измерение реагентов является важным аспектом точности и надежности химических экспериментов.
Продукты реакции: образование и свойства
Во время химической реакции, начальные вещества, называемые реагентами, претерпевают превращение и образуют новые вещества, называемые продуктами реакции. Продукты реакции имеют свои характеристики и свойства, которые могут отличаться от свойств исходных веществ.
Образование продуктов реакции происходит в результате перестройки и перераспределения атомов и ионов реагентов. Некоторые реакции могут быть полными, то есть все реагенты превращаются в продукты реакции. Другие реакции могут быть неполными, при которых образуется только часть продуктов, так как реагенты не полностью превращаются. Неполные реакции характерны для равновесных систем.
Свойства продуктов реакции могут включать физические и химические свойства. Физические свойства продуктов реакции могут быть определены без изменения химической структуры вещества. К ним относятся цвет, запах, температура плавления и кипения, плотность и т.д. Химические свойства продуктов реакции определяются их способностью взаимодействовать с другими веществами и проявлять химическую активность.
| Примеры свойств продуктов реакции | Описание |
|---|---|
| Цвет | Продукты реакции могут иметь отличный цвет от исходных веществ. Например, при окислении железа образуется ржавчина, которая имеет красно-коричневый цвет. |
| Температура плавления и кипения | Продукты реакции могут иметь различные температуры плавления и кипения по сравнению с исходными веществами. Например, вода (H2O) превращается в пар при температуре 100 °C, тогда как исходный водород (H2) и кислород (O2) остаются в газообразном состоянии при гораздо более высоких температурах. |
| Реакционная активность | Продукты реакции могут проявлять новые химические свойства и способность взаимодействовать с другими веществами. Например, оксид алюминия (Al2O3) обладает кислотностью и может реагировать с щелочными растворами. |
| Растворимость | Продукты реакции могут иметь различную растворимость в различных растворителях. Например, многие соли могут растворяться в воде, но не растворяться в органических растворителях. |
Изучение продуктов реакции и их свойств имеет важное значение для понимания протекания химических процессов и развития новых веществ с нужными свойствами в различных областях науки и технологии.
Побочные продукты: неизбежное явление

Во многих химических реакциях, происходящих в природе или в лаборатории, образуются не только основные продукты реакции, но и так называемые побочные продукты. Побочные продукты возникают в результате побочных реакций, которые сопровождают главную реакцию.
Побочные продукты могут иметь различные физические и химические свойства, и их образование может быть неизбежным явлением. Например, в органической химии при проведении сложных синтезов, могут образовываться различные побочные продукты, такие как соли, оксиды или нестабильные вещества.
| Факторы, влияющие на образование побочных продуктов | Примеры побочных продуктов |
|---|---|
| Температура реакции | Побочные продукты с высокой теплостойкостью |
| Вещества, присутствующие в реакционной среде | Ионные соли или органические соединения |
| Давление | Полимерные вещества или вещества с высокими молекулярными массами |
Побочные продукты могут играть как положительную, так и отрицательную роль. Некоторые из них могут быть полезными, например, в медицине или промышленности, и использоваться в процессе производства. Однако, в большинстве случаев побочные продукты могут вызывать нежелательные эффекты, такие как загрязнение окружающей среды или негативное воздействие на здоровье.
В заключение, побочные продукты являются неотъемлемой частью химических реакций и их образование может быть неизбежным. Понимание процессов образования побочных продуктов позволяет улучшить эффективность реакций или предпринять меры по контролю их образования.
Реакционные условия: влияние на ход процесса
Температура - один из самых важных факторов, влияющих на ход реакции. Увеличение температуры обычно увеличивает скорость реакции, так как реагенты обладают большей энергией и частицы двигаются быстрее, что способствует успешным столкновениям молекул. В некоторых случаях, повышение температуры может также изменить направление реакции и способствовать образованию большего количества продуктов.
Концентрация реагентов - также может оказывать существенное влияние на скорость реакции. Увеличение концентрации реагентов, обычно, приводит к увеличению скорости реакции, так как увеличивается вероятность столкновений молекул. Это объясняется тем, что при более высокой концентрации реагентов частицы могут постоянно сталкиваться друг с другом.
Давление - влияет на ход процесса только для реакций газообразных веществ. Увеличение давления обычно увеличивает скорость реакции, так как увеличивает вероятность столкновений молекул. В случае реакции газовых компонентов, уменьшение объёма реакционной смеси (повышение давления) может способствовать увеличению количества молекул реагента в единице объёма реакционной смеси и, соответственно, увеличению скорости химической реакции.
Катализаторы - вещества, которые ускоряют химическую реакцию, не участвуя в ней самой. Катализаторы снижают энергию активации реакции, что делает её более эффективной. Они могут быть органическими или неорганическими веществами, и их наличие или отсутствие может значительно влиять на ход реакции.
Следует отметить, что влияние реакционных условий на ход процесса может быть различным в зависимости от конкретных реагентов и механизма реакции. Поэтому, при проведении экспериментов и планировании химических процессов, необходимо учитывать и устанавливать оптимальные реакционные условия для достижения желаемых результатов.
Катализаторы: активная помощь реакции

Основной принцип действия катализаторов состоит в создании специальной ситуации на поверхности реагирующих веществ, которая способствует образованию активного комплекса и ускорению стадии переходного состояния реакции. Катализаторы часто формируют специфические активные центры, которые могут связываться с молекулами реагентов и проводить их к нужным порогам энергии активации.
Одной из наиболее распространенных форм катализа является гетерогенный катализ, где катализатор присутствует в одной фазе с реакционной смесью. Такие катализаторы обычно представляют собой твердые вещества, например, металлы или их соединения, покрытые реакционными газами или жидкостями. Это позволяет повысить поверхность катализатора, обеспечить контакт с реагентами и улучшить эффективность взаимодействия.
| Примеры катализаторов: | Примеры реакций, ускоряемых катализаторами: |
|---|---|
| Платина (Pt) | Гидрогенирование ненасыщенных углеводородов |
| Железо (Fe) | Хабер-Бош-процесс (синтез аммиака) |
| Никель (Ni) | Водородация алкенов |
| Рутений (Ru) | Окисление аммиака в кислороде |
Катализаторы используются во многих отраслях промышленности, от нефтепереработки и производства полимеров до производства лекарственных препаратов и пищевой промышленности. Они позволяют значительно сокращать время и энергозатраты на проведение реакций и улучшать выход желаемого продукта. Также катализаторы играют важную роль в энергетике, позволяя эффективно производить конверсию и хранение энергии в более устойчивых формах.
Температура: фактор, определяющий скорость реакции
При повышении температуры, молекулы начинают двигаться быстрее и чаще сталкиваются друг с другом. Более энергичные столкновения имеют большую вероятность привести к образованию переходного состояния и, следовательно, увеличить скорость реакции.
| Температура | Скорость реакции |
|---|---|
| Низкая | Медленная |
| Высокая | Быстрая |
Увеличение температуры также может повысить эффективность коллизий, что означает, что больше молекул на реакционном пути имеют энергию, достаточную для преодоления энергетического барьера реакции.
Основываясь на законе Аррениуса, можно утверждать, что каждое повышение температуры на 10 градусов Цельсия примерно удваивает скорость химической реакции.
Температура является одним из контролируемых факторов при проведении химических реакций в лаборатории и промышленности. Изучение ее влияния позволяет управлять скоростью реакции и получать желаемые продукты с оптимальной эффективностью.
Концентрация реагентов: важный параметр

Концентрация реагентов влияет на скорость реакции и итоговый результат. Повышение концентрации увеличивает вероятность столкновения молекул реагентов и, следовательно, увеличивает скорость реакции. Однако, при достижении определенной концентрации, реакция может достичь равновесия и скорость реакции устойчиво снизится.
Концентрация реагентов также может играть роль в определении степени протекания химической реакции. В некоторых случаях, если концентрация реагентов недостаточно высока, реакция может быть неполной и образуются лишь часть возможного продукта. Наоборот, увеличение концентрации может способствовать образованию побочных продуктов или реакций побочного характера.
Точное определение оптимальной концентрации реагентов является задачей, требующей проведения экспериментов и анализа данных. Концентрация реагентов является важным фактором в проведении химических реакций и требует учета и контроля для достижения желаемых результатов.
| Единицы измерения концентрации | Описание |
|---|---|
| Молярность | Количество вещества реагента, выраженное в молях на единицу объема реакционной смеси |
| Процентное содержание | Количество вещества реагента, выраженное в процентах от общего количества вещества в реакционной смеси |
| Мольная доля | Количество вещества реагента, выраженное в отношении его количества к общему количеству вещества в смеси |
Вода: универсальный растворитель в химических реакциях
Растворение вещества в воде может предшествовать химической реакции или быть ее частью. Водные растворы обладают специфическими свойствами, такими как электропроводность и изменение pH, которые могут влиять на протекание химических реакций.
Вода также может участвовать в химических реакциях сама по себе. Например, при гидролизе, вода разбивается на ионы гидроксида и водорода, что может привести к образованию новых веществ. Этот процесс очень важен во многих биохимических реакциях, таких как дыхание и пищеварение.
Кроме того, вода может выступать в роли агента окисления или восстановления в химических реакциях. Например, при окислительно-восстановительных реакциях водород может быть окислен, а кислород в воде - восстановлен.
Таким образом, вода играет важную роль в химических реакциях, как растворитель, участник реакции и агент окисления-восстановления. Понимание ее свойств и химической природы помогает углубить знания о многих процессах, происходящих в природе и в лаборатории.








