Ионные соединения - это тип химических соединений, которые образуются путем обмена электронами между атомами. В ионных соединениях атомы становятся заряженными частицами, называемыми ионами, которые притягиваются друг к другу электростатическим притяжением. Это приводит к образованию кристаллической структуры, в которой ионы располагаются в регулярных решетках.
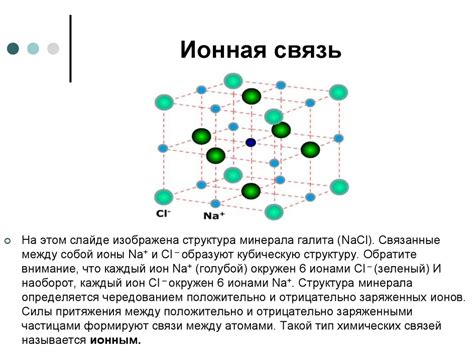
Один из наиболее известных примеров ионного соединения - поваренная соль (хлорид натрия, NaCl). В этом соединении один атом натрия отдает один электрон атому хлора, что делает натрий положительным ионом (Na+) и хлорид отрицательным ионом (Cl-). Эти ионы притягиваются друг к другу и образуют кристаллическую решетку поваренной соли.
Другим примером ионного соединения является оксид железа (III) (Fe2O3), известный также как ржавчина. В этом соединении два атома железа отдают три электрона трем атомам кислорода, что делает железо положительными ионами (Fe3+) и кислород отрицательными ионами (O2-). Эти ионы притягиваются друг к другу и образуют кристаллическую структуру оксида железа (III).
Ионные соединения являются важными в химии и имеют широкий спектр применений. Они используются для производства стекла, керамики, пластмасс и других материалов. Они также являются основой для формирования электролитов в батареях и аккумуляторах, а также для проведения электролиза в процессах химической промышленности.
Что такое ионное соединение: определение и примеры

Основное свойство ионных соединений - их кристаллическая структура. В данной структуре положительно и отрицательно заряженные ионы располагаются в определенном порядке и притягиваются друг к другу с помощью кулоновских сил.
Примеры ионных соединений:
- Хлорид натрия (NaCl) - образуется из атомов натрия и хлора. Натрий отдает одну электронную пару хлору, образуя ион Na+, а хлор получает электронную пару, образуя ион Cl-.
- Оксид магния (MgO) - образуется из атомов магния и кислорода. Магний отдает две электронные пары кислороду, образуя ион Mg2+, а кислород получает эти пары, образуя ион O2-.
- Сульфат меди (CuSO4) - образуется из атомов меди, серы и кислорода. Медь отдает две электронные пары сере и одну электронную пару кислороду, образуя ион Cu2+, а сера получает эти пары, образуя ион S2-, а кислород получает от меди еще одну электронную пару и становится однозарядным отрицательным ионом O2-.
Ионные соединения встречаются в природе в виде минералов и солей. Они имеют широкое применение в различных областях, таких как фармацевтика, химическая промышленность, сельское хозяйство и другие.
Определение ионного соединения
Ионным соединением называется химическое соединение, образованное электростатическим притяжением положительно и отрицательно заряженных ионов. В ионных соединениях атомы обычно теряют или получают один или несколько электронов, образуя положительные и отрицательные ионы соответственно.
В кристаллической решетке ионного соединения положительные и отрицательные ионы располагаются в определенном порядке, образуя устойчивую структуру. Ионные соединения обычно обладают хорошей проводимостью в расплавленном состоянии или в растворах, а в твердом состоянии имеют высокую температуру плавления и обычно являются хрупкими и непроводящими в электрическом поле.
Примерами ионных соединений являются NaCl (хлорид натрия), CaCO3 (карбонат кальция), MgO (оксид магния) и многие другие вещества, состоящие из металлических и неметаллических элементов.
Какие элементы образуют ионные соединения?
Ионные соединения обычно образуются между металлами и неметаллами в результате передачи электронов из металла в неметалл, что приводит к образованию положительных и отрицательных ионов. Основные элементы, которые образуют ионные соединения, включают:
- Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb), образуют ионные соединения с неметаллами, такими как хлор (Cl) и кислород (O).
- Щелочноземельные металлы, такие как магний (Mg), кальций (Ca) и стронций (Sr), также образуют ионные соединения с неметаллами.
- Образцы из группы 13 (бор (B), алюминий (Al)) и группы 14 (углерод (C), кремний (Si)) также могут образовывать ионные соединения.
- Полиатомные ионы, такие как сульфат (SO42-), карбонат (CO32-) и нитрат (NO3-), также могут участвовать в образовании ионных соединений.
Эти элементы образуют стабильные ионные соединения с помощью электронного переноса, что предоставляет им электростатическую прочность и характерные физические и химические свойства.
Химическая формула ионного соединения
Химическая формула ионного соединения представляет собой запись, отражающую состав ионного соединения. В формуле указываются символы химических элементов и их количество в соединении.
Химическая формула ионного соединения состоит из двух частей: катиона и аниона. Катион, как правило, представляет положительно заряженный ион, а анион - отрицательно заряженный ион.
В ионном соединении положительный ион располагается слева от отрицательного иона. Количество ионов указывается с помощью численных коэффициентов, записываемых после символов ионов.
Например, химическая формула ионного соединения натрия и хлора - NaCl. В этом соединении натрий (Na) представляет катион, а хлор (Cl) - анион. Формула указывает, что в соединении присутствует один ион натрия и один ион хлора.
Еще одним примером ионного соединения является сернистый ангидрид - SO2. В этом соединении сера (S) представляет катион, а кислород (O) - анион. Формула указывает, что в соединении присутствует один ион серы и два иона кислорода.
Как образуются ионные соединения?
Ионные соединения образуются в результате химической реакции между металлами и неметаллами. Образование ионных соединений происходит благодаря передаче электронов от одного атома к другому, что приводит к образованию ионов с противоположными зарядами.
Процесс образования ионного соединения можно разделить на следующие шаги:
- Атом металла отдает одно или несколько электронов, становясь положительно заряженным ионом (катионом).
- Атом неметалла принимает одно или несколько электронов, становясь отрицательно заряженным ионом (анионом).
- Полученные ионы притягиваются друг к другу противоположными зарядами и образуют электрически нейтральное ионное соединение.
Свойства и химическая активность ионных соединений зависят от зарядов ионов и их взаимного расположения в кристаллической решетке.
Примером ионного соединения является хлорид натрия (NaCl), образующийся в результате реакции между натрием (Na) и хлором (Cl). В этом соединении натрий отдает электрон, становясь катионом Na+, а хлор принимает электрон, становясь анионом Cl-. Образованные ионы Na+ и Cl- притягиваются друг к другу, образуя кристаллическую решетку хлорида натрия.
Процесс образования ионного соединения
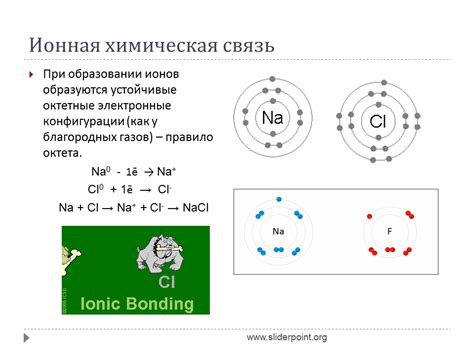
Ионное соединение образуется в результате обмена электронами между атомами разных элементов. Этот процесс может происходить с участием металлов и неметаллов или между двумя неметаллами.
При образовании ионного соединения атомы металла отдают одно или несколько электронов внешней электронной оболочки и становятся положительно заряженными ионами, называемыми катионами. Атомы неметалла, наоборот, принимают эти электроны и образуют отрицательно заряженные ионы, называемые анионами.
Получившиеся катионы и анионы притягиваются друг к другу электростатической силой и образуют кристаллическую структуру ионного соединения. В результате обмена электронами обоими типами атомов, ионные соединения обладают электрической нейтральностью, так как количество положительных и отрицательных зарядов равно между собой.
Примеры ионных соединений включают в себя несколько классических соединений, таких как хлорид натрия (NaCl), оксид кальция (CaO), сульфат магния (MgSO4) и нитрат аммония (NH4NO3).
Примеры ионных соединений

Ионные соединения встречаются повсюду в природе и составляют множество веществ, которые нас окружают. Некоторые из примеров ионных соединений включают следующие:
1. Хлорид натрия (NaCl): Хлорид натрия, также известный как кухонная соль, является одним из самых распространенных ионных соединений. Он состоит из катиона натрия (Na+) и аниона хлорида (Cl-).
2. Карбонат кальция (CaCO3): Карбонат кальция встречается в виде минерала известняка. Он содержит катион кальция (Ca2+) и анион карбоната (CO32-).
3. Сульфат магния (MgSO4): Сульфат магния, также известный как эпсомская соль, содержит катион магния (Mg2+) и анионы сульфата (SO42-).
4. Фосфат аммония (NH43PO4): Фосфат аммония используется в качестве удобрения. Он содержит катионы аммония (NH4+) и анионы фосфата (PO43-).
5. Гидроксид натрия (NaOH): Гидроксид натрия, известный также как щелочь, содержит катион натрия (Na+) и анион гидроксида (OH-).
6. Фторид калия (KF): Фторид калия используется в зубной пасте и является очень отравляющим веществом. Он состоит из катиона калия (K+) и аниона фторида (F-).
И это только небольшая часть ионных соединений, которые встречаются в нашей повседневной жизни. Ионные соединения имеют разнообразные применения в различных отраслях, таких как промышленность, медицина, сельское хозяйство и технологии.
Значение ионных соединений в химии
В ионных соединениях, катионы и анионы притягиваются друг к другу электростатической силой, образуя кристаллическую решетку. Эти соединения обычно обладают высокой температурой плавления и кипения, а также в большинстве случаев образуют растворы, которые проводят электрический ток.
Основной пример ионного соединения - соль. Соли образуются при реакции между кислотой и основанием, когда положительный ион водорода (протон) кислоты замещается металлическим катионом, например, натрием, и образуется анион. Примером соли является хлорид натрия (NaCl).
Ионные соединения имеют широкую практическую значимость. Они используются в производстве стекла, керамики, удобрений, лекарств, а также во многих других отраслях промышленности.
Изучение ионных соединений позволяет лучше понять основные принципы химических реакций и свойства веществ, а также применять этот знания в различных областях науки и технологии.








