Ионная форма уравнения является основой для многих химических расчетов и реакций. Она представляет собой запись реакции в ионном виде, где ионы являются основными участниками. Ионная форма уравнения позволяет наглядно представить состав и структуру реакции, а также просто и эффективно производить различные расчеты и сравнения.
Понятие ионной формы уравнения основывается на том, что химическая реакция в основе представляет собой превращение веществ, проходящее через образование ионов. Ионы представляют собой заряженные частицы, которые могут быть положительно или отрицательно заряжеными. Записывая реакцию в ионной форме, мы указываем все образующиеся ионы и их заряды.
Применение ионной формы уравнения широко распространено в химических расчетах и прогнозировании реакций. Она позволяет нам понять, какие вещества будут образовываться при данной реакции, и какие ионы будут взаимодействовать между собой. Благодаря ионной форме уравнения мы можем определить количество ионов и реагентов, а также рассчитать их концентрацию и реакционную способность.
Кроме того, ионная форма уравнения позволяет лучше понять механизмы химических реакций и процессов. Мы можем исследовать взаимодействие ионов, а также проследить за образованием и разрушением химических связей. Использование ионной формы уравнения помогает нам углубить наши знания в области химии и получить более полное представление о молекулярной структуре веществ.
Что такое ионная форма уравнения?

Ионы – это заряженные атомы или молекулы, которые могут быть положительно или отрицательно заряженными. В ионной форме уравнения показываются ионы каждого реагента и продукта, а также их количество. Заряд ионов указывается в верхнем индексе рядом с их символами.
Ионная форма уравнения особенно полезна при изучении кислотно-щелочных реакций, где ионы гидроксида, гидроксония и различных кислот взаимодействуют между собой. Например, уравнение реакции растворения кислоты может быть записано в ионной форме, где ионы водорода и гидроксония указывают на протекание процесса.
Ионная форма уравнения также используется для более точного расчета количества ионов, участвующих в реакции, и определения стехиометрических соотношений между реагентами и продуктами. Она помогает более полно и точно описать процесс химической реакции и упрощает его анализ и изучение.
Определение и основные принципы
Ионные уравнения позволяют выделить основные реагенты и продукты реакции, а также увидеть изменение заряда участвующих в реакции ионов. Данное представление позволяет более наглядно описывать процессы, происходящие при взаимодействии веществ и удобно использовать в различных расчетах и анализе реакций.
Основной принцип ионной формы уравнения заключается в том, что все реагенты и продукты реакции представляются ионами, а их заряды учитываются при записи уравнения. Кроме того, в ионном уравнении должны быть указаны состояния веществ – например, газообразное, твердое или растворенное в воде.
Для составления ионных уравнений необходимо знать химические формулы реагентов и продуктов, а также заряды ионов. При этом следует учитывать массу каждого иона и его степень диссоциации, если речь идет о растворе.
Ионные уравнения являются важным инструментом в изучении реакций в растворах и электрохимических процессов. Они позволяют более точно описывать происходящие изменения, а также понимать характер взаимодействия веществ.
Примеры использования ионной формы уравнения
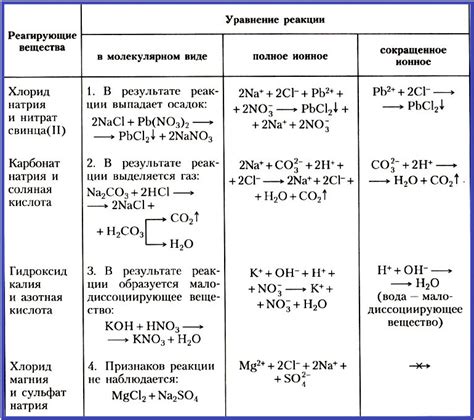
Ионная форма уравнения представляет собой запись химической реакции, в которой вещества представлены в виде ионов. Использование ионной формы уравнения позволяет более наглядно представить происходящие процессы, особенно в растворах.
Ниже приведены примеры использования ионной формы уравнения:
- Пример 1: Реакция между кислотой и основанием. Например, реакция между серной кислотой (H2SO4) и натриевым гидроксидом (NaOH) может быть записана в ионной форме следующим образом:
- Пример 2: Реакция образования осадка. Например, при смешении растворов серной кислоты (H2SO4) и бария хлорида (BaCl2) образуется барийсульфат (BaSO4), который выпадает в виде осадка:
- Пример 3: Реакция окисления. Например, реакция окисления железа (Fe) кислородом (O2) может быть записана в ионной форме следующим образом:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
H2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2HCl(aq)
4Fe(s) + 3O2(g) → 2Fe2O3(s)
В каждом из этих примеров ионная форма уравнения позволяет увидеть, какие ионы входят в реакцию и что происходит с ними. Это может быть полезно для анализа реакции, предсказания образующихся продуктов и понимания сущности химических процессов.
Химические реакции в растворах
В растворах могут происходить различные типы химических реакций, такие как:
- Окислительно-восстановительные реакции, где происходит передача электронов между реагентами.
- Протолитические реакции, где происходит образование или разрушение химических связей между ионами.
- Прекурсорные реакции, где реагируют молекулы или ионы и образуются прекурсоры, из которых затем могут произойти другие реакции.
Важной особенностью реакций в растворах является то, что ионы, образующиеся в результате реакций, могут легко перемещаться в растворе и взаимодействовать с другими ионами. Это позволяет проводить различные аналитические исследования, а также использовать растворы в химических процессах, таких как электрохимические реакции.
Применение ионной формы уравнения позволяет детально изучать реакции, происходящие в растворах. Ионная форма уравнения показывает все ионы, участвующие в реакции, и их сродства друг к другу. Это позволяет более точно предсказывать химические реакции и исследовать их свойства.
| Пример ионного уравнения: | Пример молекулярного уравнения: |
|---|---|
| 2HCl + 2AgNO3 → 2AgCl + 2HNO3 | 2HCl + Ag2CO3 → AgCl + H2O + CO2 |
В ионном уравнении видно, что ионы H+ и Cl- реагируют с ионами Ag+ и NO3-, образуя молекулы AgCl и HNO3. В молекулярном уравнении видны все вещества, участвующие в реакции.
Электролиз

В ходе электролиза происходит перенос зарядов через электролит. Катионы (положительно заряженные ионы) перемещаются к катоду, а анионы (отрицательно заряженные ионы) - к аноду. При достижении электродов ионами, они могут быть разделены на элементы или соединены с элементами электрода, в зависимости от их свойств.
Важным применением электролиза является получение металлов из их солей. Например, вольфрам может быть получен электролизом иодида вольфрама. При этом ион вольфрама (W^6+) соединяется на катоде с электродом, формируя металлический вольфрам.
| Анод | Электролит | Катод |
|---|---|---|
| Металл Mt | Катион Mt^2+ | Металл Mt |
Электролиз также используется для разделения воды на кислород и водород. При этом кислород образуют на аноде, а водород - на катоде.
Химические реакции в электролизе могут быть представлены в ионной форме уравнений, которые позволяют лучше понять состав и характер происходящих процессов.








