Химическое равновесие является одним из основных понятий в химии. Оно описывает состояние системы, при котором скорости прямой и обратной реакций становятся равными и концентрации реагентов и продуктов перестают меняться. В химической реакции смещение равновесия вправо означает увеличение концентрации продуктов.
Смещение равновесия вправо может происходить под действием различных факторов. Возможными причинами могут служить повышение температуры, увеличение концентрации продуктов или уменьшение концентрации реагентов. Также смещение равновесия вправо может быть вызвано изменением давления или добавлением каталитических веществ.
В результате смещения равновесия вправо количество продуктов реакции увеличивается, а количество реагентов уменьшается. Это может быть важно для ряда химических процессов. Например, в производстве аммиака смещение равновесия вправо позволяет увеличить выход продукта и повысить эффективность процесса.
Понимание смещения равновесия вправо и его факторов позволяет улучшить промышленные процессы, разработать эффективные катализаторы и улучшить понимание причин происходящих в химических реакциях.
Смещение химического равновесия вправо: значение и механизмы

Когда равновесие смещается вправо, продукты реакции становятся преобладающими над реагентами. Это может быть полезно для химических процессов, таких как синтез новых веществ или повышение выхода продукта в промышленных процессах.
Смещение равновесия вправо может быть достигнуто различными способами. Например, увеличение концентрации продуктов или уменьшение концентрации реагентов может сместить равновесие вправо. Также, увеличение давления или увеличение температуры могут стимулировать смещение вправо.
Механизмы смещения равновесия вправо могут быть различными, и зависят от конкретной реакции. Например, в реакциях с образованием газов смещение может происходить в сторону уменьшения давления. В реакциях с изменением концентраций реагентов и продуктов, смещение может происходить в сторону увеличения концентрации реактивов.
Смещение равновесия вправо является основной целью многих химических реакций, и его понимание является важным для контроля и оптимизации процессов химической синтеза. Изучение механизмов смещения равновесия вправо позволяет улучшить эффективность и эффективность химических процессов, что полезно в различных отраслях науки и промышленности.
Понятие химического равновесия
Равновесие между прямой и обратной реакцией достигается, когда равновесная постоянная (константа равновесия) достигает фиксированного значения. Константа равновесия определяется выражением, называемым законом действующих масс или уравнением Гиббса.
Смещение химического равновесия вправо означает то, что направление протекающей реакции смещается в сторону образования большего количества продуктов. Это может происходить в результате изменения концентрации реагентов, изменения давления или температуры, а также добавления реактивов или катализаторов.
Смещение равновесия вправо может приводить к увеличению выхода желаемых продуктов реакции, что является важным аспектом в промышленности и синтезе органических соединений.
Что означает смещение равновесия
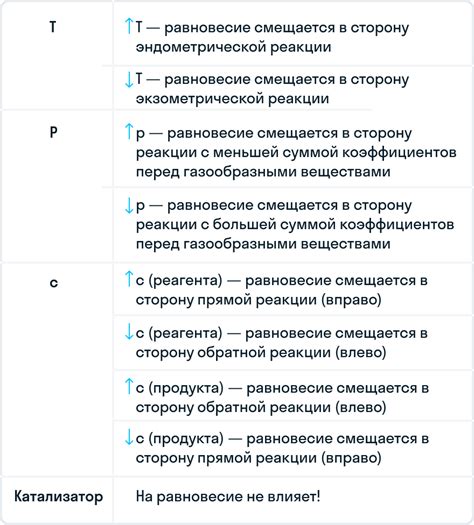
Смещение равновесия может происходить в разные стороны - вправо или влево. Смещение равновесия вправо означает, что концентрация продуктов увеличивается, а концентрация реагентов уменьшается. Это может произойти, например, при добавлении реагента, увеличении давления или изменении температуры.
Смещение равновесия влево, наоборот, означает, что концентрация реагентов увеличивается, а концентрация продуктов уменьшается. Это может произойти, если убрать часть продукта из системы или увеличить концентрацию реагентов.
Смещение равновесия вправо или влево имеет важные практические последствия. Например, в химической промышленности смещение равновесия вправо может быть желательным, так как это приводит к увеличению выхода продукта. Однако, в некоторых случаях смещение равновесия влево может быть предпочтительным, если нужно увеличить концентрацию реагента или изменить направление реакции.
Реакция на повышение концентрации продуктов
Смещение химического равновесия вправо означает, что при повышении концентрации продуктов реакции, процесс обратной реакции ускоряется, и более продуктов образуется из реагентов. Это может произойти несколькими способами:
| Способ | Объяснение |
|---|---|
| Изменение концентрации продуктов | Повышение концентрации продуктов приведет к тому, что в системе равновесия будет больше продуктов, чем реагентов. В результате, согласно принципу Ле-Шателье, равновесие сместится вправо, чтобы компенсировать потерю реагентов. |
| Увеличение давления | Если реакция сопровождается изменением объема, увеличение давления также приведет к смещению равновесия вправо. Это происходит, потому что в результате увеличения давления, объем газа уменьшается, и система равновесия смещается в ту сторону, где находится меньше газовых молекул. |
| Изменение температуры | Ваш текст |
Итак, повышение концентрации продуктов в реакции приведет к смещению равновесия вправо, увеличивая количество продуктов и уменьшая количество реагентов в системе равновесия.
Влияние температуры на равновесие

Температура играет значительную роль в процессе смещения химического равновесия. Изменение температуры может привести к смещению равновесия либо вправо, либо влево, в зависимости от реакции.
По общему правилу Ле Шателье, повышение температуры обычно приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением тепла. Другими словами, если реакция является экзотермической (поглощает тепло), увеличение температуры приведет к смещению равновесия влево, в направлении образования реакционных исходных веществ. Напротив, если реакция является эндотермической (выделяет тепло), повышение температуры приведет к смещению равновесия вправо, в направлении образования реакционных продуктов.
Снижение температуры, напротив, может привести к обратному эффекту на равновесие. Это связано с изменением энергии активации реакции и количеством энергии, передаваемым молекулярными коллизиями.
Имея понимание влияния температуры на равновесие, химики могут эффективно управлять и контролировать процессы химических реакций и достижение высокой степени конверсии продуктов.
Катализаторы и равновесие
Катализаторы, как правило, смещают равновесие реакции в правую сторону, то есть в сторону образования продуктов, и увеличивают концентрацию продуктов реакции. Это достигается путем снижения энергии активации реакции, что позволяет большему количеству частиц преодолеть этот энергетический барьер и превратиться в продукты. Таким образом, исходная реакция, которая может протекать медленно или неполно, может быть ускорена и полностью завершена при наличии катализатора.
Катализаторы могут быть разными по своей природе и свойствам. Некоторые катализаторы являются естественными веществами, такими как ферменты в организмах живых организмов. Другие катализаторы создаются специально для определенных химических процессов и имеют синтетическую природу.
| Примеры катализаторов | Реакции, в которых они используются |
|---|---|
| Платина | Конверсия оксидов азота в азот и кислород |
| Ферменты | Гидролиз пищи в желудке |
| Кислота | Эфирификация органических кислот |
Важно отметить, что катализаторы не расходуются в процессе реакции и могут быть использованы неоднократно. Также катализаторы могут быть специфичными и действовать только в определенных типах реакций.
Таким образом, катализаторы играют большую роль в равновесии химических реакций, способствуя протеканию реакции в нужном направлении и повышая конверсию реакционных компонентов.
Изменение давления и равновесие

Смещение химического равновесия вправо может происходить под влиянием изменения давления. Если в систему с равновесной реакцией оказывается внешнее давление, то равновесие может сдвинуться в ту сторону, где находятся меньшее количество молекул газа.
Для реакций, в которых участвуют газы, изменение давления влияет на распределение молекул газа в системе. Если увеличивается давление, то количество молекул газа уменьшается, и равновесие смещается в сторону уменьшения количества молекул газа. Поэтому, если вариант равновесной реакции содержит большее количество молекул газа справа, то изменение давления вправо смещает равновесие.
Например, если рассмотреть равновесную реакцию между азотом и водородом, при которой образуется аммиак:
N2 + 3H2 <=> 2NH3
В этой реакции участвуют 3 молекулы газа слева и 2 молекулы газа справа. Если увеличить давление в системе, количество молекул газа уменьшится, и равновесие сместится вправо, в сторону увеличения количества молекул газа. Это означает, что больше аммиака будет образовано.
При уменьшении давления происходит обратный эффект. Если система с равновесной реакцией подвергается снижению давления, то равновесие будет смещаться в сторону увеличения количества молекул газа. В данном случае, если уменьшить давление, равновесие сместится влево, что означает образование большего количества исходных реагентов - азота и водорода.








