Протекающие реакции - это химические реакции, которые происходят самопроизвольно и сопровождаются выделением энергии. Они происходят без внешнего воздействия и могут протекать в любой системе, где присутствуют реагенты.
Протекающие реакции классифицируются по направлению течения своих составляющих: прямые и обратные. Прямые реакции протекают от реагентов к продуктам, а обратные реакции - от продуктов назад к реагентам.
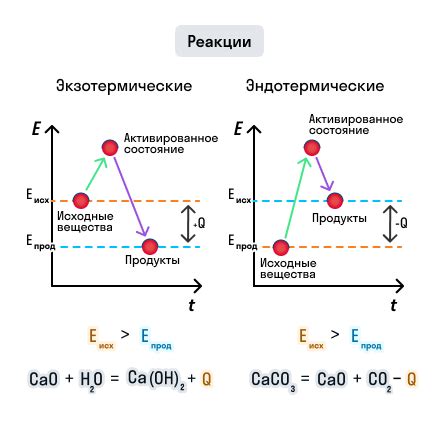
В прямых реакциях энергия активации затрачивается при превращении реагентов в продукты. Например, при горении древесины, кислород окисляет углерод, выделяя тепло и свет. В обратных реакциях, наоборот, энергия активационного барьера потребляется при образовании реагентов из продуктов. Например, древесина восстанавливается к золе и углекислому газу во время денежных азота.
Что такое протекающие реакции
Протекающие реакции могут иметь различные виды, в зависимости от характера взаимодействующих веществ. Некоторые из основных типов химических реакций включают:
- Синтезные реакции, при которых два или более вещества соединяются, образуя новое вещество. Например, реакция образования воды из водорода и кислорода: 2H2 + O2 → 2H2O.
- Разложительные реакции, при которых одно вещество распадается на два или более более простых. Например, разложение перекиси водорода: 2H2O2 → 2H2O + O2.
- Диспропорционирующие реакции, при которых одно вещество одновременно окисляется и восстанавливается, образуя два различных продукта. Например, диспропорционирование хлора: 3Cl2 → 2Cl2 + Cl2.
- Окислительно-восстановительные реакции, при которых происходит перенос электронов от одного вещества к другому. Например, реакция между цинком и серной кислотой: Zn + H2SO4 → ZnSO4 + H2.
Протекающие реакции играют важную роль в мире химии и имеют широкое применение в различных отраслях промышленности, медицине, пищевой и фармацевтической промышленности, а также в повседневной жизни.
Определение и основные черты
Одной из основных черт протекающих реакций является экзотермический характер. Это значит, что во время таких реакций выделяется энергия в виде тепла или света. При этом окружающая среда может нагреваться, искриться или иным образом проявлять изменения.
Важной чертой протекающих реакций является спонтанность. Они происходят без внешнего воздействия и требуют только того, чтобы реагенты соприкасались или находились в непосредственной близости друг от друга.
Примером протекающей реакции является горение древесины. При соприкосновении древесины с кислородом воздуха происходит реакция окисления, сопровождающаяся выделением тепла и света, что приводит к возгоранию древесины.
Виды протекающих реакций

Протекающие реакции могут быть классифицированы по различным критериям. Рассмотрим некоторые из основных видов протекающих реакций:
- Окислительно-восстановительные реакции: в таких реакциях происходит передача электронов от одного вещества к другому. Окисление - потеря электронов, а восстановление - получение электронов;
- Кислотно-щелочные реакции: это реакции, в результате которых образуются соли и вода. Кислоты отдают протоны (водородные ионы), а щелочи принимают эти протоны;
- Реакции осаждения: в таких реакциях образуются нерастворимые соединения - осадки. Это происходит при смешении двух растворов, в которых есть ионы, способные образовывать нерастворимые соединения;
- Комплексообразовательные реакции: в ходе таких реакций образуются комплексы, то есть структуры, в которых центральный металл связан с одним или несколькими лигандами;
- Диспропорционирование: это реакция, в результате которой одно вещество одновременно окисляется и восстанавливается;
- Гидролиз: процесс, при котором молекула воды расщепляется на ионы, и один из этих ионов вступает в реакцию с другой молекулой вещества.
Это лишь некоторые из многочисленных видов протекающих реакций. Каждый из этих типов реакций имеет свои особенности и может происходить в определенных условиях.
Примеры протекающих реакций
Пример 1: Окисление водорода водным раствором хлора:
2H2 + Cl2 → 2HCl
Пример 2: Ядерное распадение радия:
Ra → Rn + He
Пример 3: Горение метана в кислороде:
CH4 + 2O2 → CO2 + 2H2O
Пример 4: Реакция между кислородом и железом:
4Fe + 3O2 → 2Fe2O3
Пример 5: Реакция между серной кислотой и натрием:
H2SO4 + 2Na → Na2SO4 + 2H2
Пример 6: Гидролиз эфира:
C2H5OC2H5 + H2O → C2H5OH + C2H5OH
Пример 7: Реакция нейтрализации между кислотой и щелочью:
HCl + NaOH → NaCl + H2O
Пример 8: Реакция синтеза воды:
2H2 + O2 → 2H2O
Пример 9: Окисление железа кислородом в воздухе:
4Fe + 3O2 → 2Fe2O3
Пример 10: Реакция между кальцием и хлором:
Ca + Cl2 → CaCl2








