Кислоты – это химические соединения, которые широко используются в промышленности, медицине и повседневной жизни. Кислоты обладают рядом особых свойств, которые делают их полезными в различных областях. Они могут быть жидкими или твердыми веществами и иметь сильный характерный запах. Кислоты способны реагировать с металлами и образовывать соль и водород.
Оксиды – это также химические соединения, которые образуются при взаимодействии кислорода с другими элементами. Они могут быть в виде газов, жидкостей или твердых веществ. Оксиды тоже имеют ряд свойств, которые делают их важными в различных сферах. Они могут быть кислотными или щелочными в зависимости от pH значения.
Кислоты и оксиды тесно связаны между собой. Кислоты состоят из атомов, связанных в молекуле, а оксиды содержат кислород как один из компонентов. Кислоты могут давать оксиды путем окисления, а оксиды, в свою очередь, могут образовывать кислоты взаимодействуя с водой. Эта взаимосвязь между кислотами и оксидами играет важную роль в химических процессах и является одной из основ химии.
Кислота и ее свойства
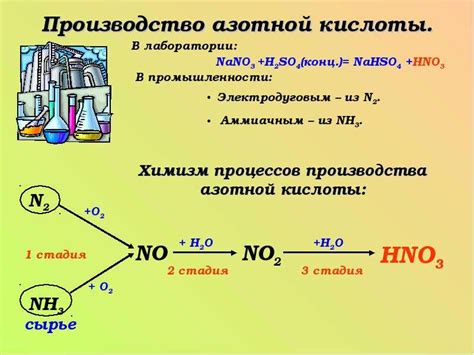
Важным свойством кислоты является ее диссоциация в водном растворе. Когда кислота растворяется в воде, она расщепляется на ионы водорода (H+) и анионы кислоты. Степень диссоциации зависит от концентрации и свойств самой кислоты.
Часто кислоты используются в химической промышленности, медицине, пищевой промышленности и других отраслях. Они применяются для регулирования pH веществ, нейтрализации щелок, проведения химических реакций и многих других целей.
| Свойство | Описание |
|---|---|
| Кислотный вкус | Многие кислоты обладают кислым вкусом. Например, лимонная кислота, уксусная кислота и многие другие. |
| Диссоциация в воде | Кислоты диссоциируют в водном растворе на ионы H+ и анионы кислоты. Это свойство обусловлено способностью кислоты отдавать протоны (H+). |
| Реакция с щелочью | Кислоты реагируют со щелочами, образуя соли и воду. Эта реакция называется нейтрализацией. |
| Реакция с металлами | Некоторые кислоты реагируют с металлами, образуя соли и выделяя водород. Например, хлороводородная кислота реагирует с цинком, образуя хлорид цинка и выделяя водородный газ. |
Из чего состоит кислота?
Кислота представляет собой химическое соединение, состоящее из водорода и одного или нескольких неметаллических элементов. Обычно они образуются путем соединения неметалла с кислородом.
Кислоты могут быть органическими, то есть содержащими углерод, и неорганическими. Они имеют разнообразные физические и химические свойства.
Органические кислоты включают такие вещества, как уксусная кислота, лимонная кислота и многое другое. Неорганические кислоты могут быть минеральными, например, серной кислотой, азотной кислотой и хлороводородной кислотой.
Реакция оксида с водой может также приводить к образованию кислоты. Например, оксид серы (SO2) и оксид азота (NO2) реагируют с водой, образуя серную и азотную кислоту соответственно.
Какие свойства имеет кислота?

- Кислоты обладают кислотным вкусом и запахом.
- Они способны реагировать с щелочными веществами, образуя соли и воду.
- Кислоты могут образовывать электролитные растворы, которые проводят электрический ток.
- Они вызывают раздражение на коже и слизистых оболочках.
- Некоторые кислоты обладают отбеливающими свойствами.
- Кислоты могут коррозировать металлы, образуя с ними соответствующие соли и выделяя водородный газ.
- Они обладают реакцией с индикаторами и меняют их цвет.
- Кислоты могут образовывать пары, которые могут вызывать ожоги и раздражение глаз.
Все эти свойства делают кислоты важными в различных областях, включая химическую промышленность, медицину и кулинарию. Они играют важную роль в процессах пищеварения, озонового слоя и биологических реакциях в организмах.
Вещества, являющиеся кислотами
Одним из наиболее известных примеров кислоты является соляная кислота (HCl). Она является одной из наиболее сильных кислот в чистом виде и обычно находится в виде раствора. Соляная кислота используется в промышленности, медицине и научных исследованиях.
Ещё одним примером кислоты является серная кислота (H2SO4). Она является одной из самых мощных кислот и широко используется в различных отраслях промышленности, включая производство удобрений, красящих веществ и пластмасс.
Кислоты также могут быть органическими – это кислоты, содержащие углерод. Например, уксусная кислота (CH3COOH) – это органическая кислота, которая находится в таких продуктах, как уксус и винный уксус.
Реакции кислот с другими веществами
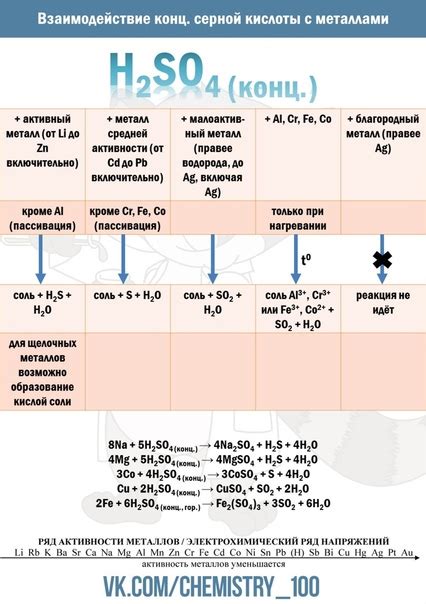
Кислоты обладают выраженным химическим активностью и способны взаимодействовать с различными веществами.
1. Реакция кислоты с основанием:
- При взаимодействии кислоты с основанием происходит образование соли и воды.
- Пример реакции: HCl + NaOH → NaCl + H2O
2. Реакция кислоты с металлом:
- Кислота реагирует с металлом, образуя соль и выделяя водород.
- Пример реакции: 2HCl + Zn → ZnCl2 + H2
3. Реакция кислоты с основанием и металлом одновременно:
- При одновременном взаимодействии кислоты с основанием и металлом образуются соль и вода, а металлический катион восстанавливается.
- Пример реакции: 2HCl + Mg(OH)2 → MgCl2 + 2H2O
4. Реакция кислоты с водородом:
- Некоторые кислоты, такие как серная и хлорная кислоты, могут взаимодействовать с водородом, выделяя энергию.
- Пример реакции: H2SO4 + 2H2 → S + 4H2O
5. Реакция кислоты с оксидом:
- Кислота взаимодействует с оксидом и образует соль и воду.
- Пример реакции: 2HNO3 + CaO → Ca(NO3)2 + H2O
Реакции кислот с другими веществами позволяют получать различные продукты и широко применяются в химической промышленности, медицине и других отраслях науки и техники.
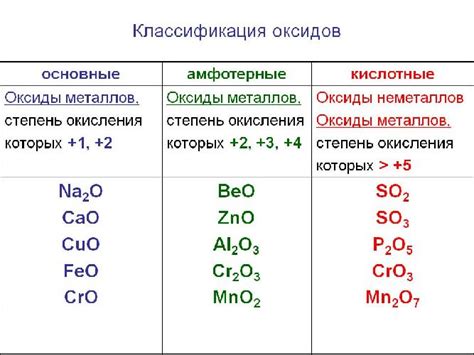
Оксиды и их характеристики
Оксиды могут быть металлическими и неметаллическими. Металлические оксиды образуются при взаимодействии металлов с кислородом и представляют собой ионы металла в окружении кислородных ионов. Неметаллические оксиды, напротив, образуются при взаимодействии неметаллов с кислородом и содержат ионы неметалла и кислородные ионы.
Оксиды могут проявлять различные химические свойства. Некоторые оксиды обладают щелочными свойствами, реагируя с водой и образуя щелочные растворы. Эти оксиды называются щелочными оксидами.
Другие оксиды могут проявлять кислотные свойства, реагируя с водой и образуя кислотные растворы. Такие оксиды называются кислотными оксидами. Например, диоксид серы (SO2) является кислотным оксидом и образует сернистую кислоту, а угольный диоксид (CO2) - карбоновую кислоту.
Также существуют оксиды, которые не проявляют ни кислотные, ни щелочные свойства. Эти оксиды называются нейтральными оксидами и образуют нейтральные растворы, не изменяя кислотно-щелочной среды.
Оксиды играют важную роль во многих отраслях науки и промышленности. Они используются в производстве стекла, керамики, металлов, а также в химической промышленности для получения различных соединений.
- Металлические оксиды:
- Оксид железа (Fe2O3)
- Оксид алюминия (Al2O3)
- Оксид коппера (CuO)
- Углекислый газ (CO2)
- Оксид азота (NO2)
- Оксид серы (SO2)
Что такое оксид?
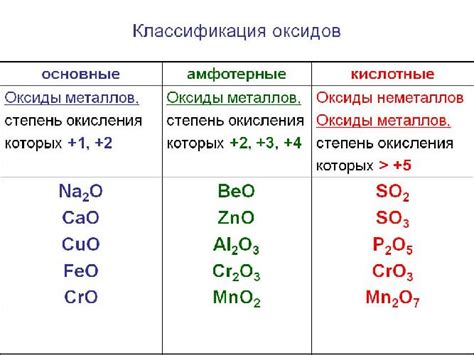
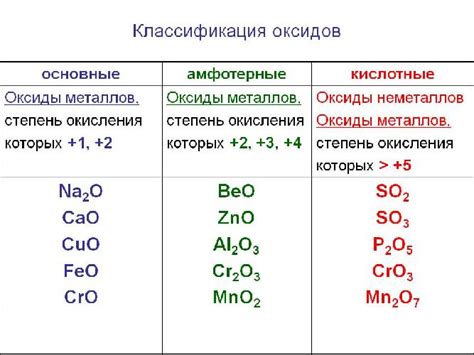
Оксиды образуются в результате реакции кислорода с другими элементами. При этом электроотрицательный кислород принимает электроны от элемента с меньшей электроотрицательностью, образуя отрицательно заряженные оксидные ионы. Оксидные ионы могут принимать различные степени окисления, в зависимости от элемента, с которым они связаны. Например, оксид кальция CaO имеет степень окисления +2, а оксид алюминия Al2O3 имеет степень окисления +3.
Оксиды могут иметь различные физические свойства, в зависимости от состава и структуры соединения. Некоторые оксиды, такие как окалины (CaO), известь (CaO) и оксид магния (MgO), обладают щелочными свойствами и используются в производстве цемента и стекла. Другие оксиды, такие как оксид алюминия (Al2O3) и оксид железа (Fe2O3), обладают кислотными свойствами и являются важными компонентами в производстве керамики и красок. Есть также оксиды, которые обладают амфотерными свойствами, то есть они могут проявлять и кислотные, и щелочные свойства, например оксиды алюминия и свинца.
Одним из самых известных оксидов является вода (H2O), которая является оксидом водорода (H) и кислорода (O). Вода имеет уникальные свойства и является жизненно важным соединением для всех организмов на Земле.
| Примеры оксидов | Формула |
|---|---|
| Оксид кальция | CaO |
| Оксид алюминия | Al2O3 |
| Оксид железа(III) | Fe2O3 |
| Оксид магния | MgO |
Какие свойства имеют оксиды?
| 1. | Оксиды обладают высокой термической и стехиометрической устойчивостью. |
| 2. | Многие оксиды обладают свойствами кислот или оснований. Кислотные оксиды образуют кислоты при реакции с водой, а основные оксиды образуют основания при растворении в воде. |
| 3. | Оксиды часто обладают химической активностью и могут реагировать с другими веществами, образуя новые соединения. |
| 4. | Некоторые оксиды могут быть использованы в качестве катализаторов, то есть они способны ускорять химические реакции без изменения своей структуры. |
Свойства оксидов зависят от состава и структуры этого соединения. Например, металлические оксиды обычно являются основными, тогда как неметаллические оксиды – кислотными. Однако есть и исключения из правил: оксиды некоторых металлов могут проявлять свойства кислот или оснований в зависимости от условий реакции.
Кислота и ее соответствие оксиду
Когда кислота реагирует с оксидом, происходит образование соли и воды. Соответствие кислоты и оксида обычно основывается на химической формуле и стехиометрии реакции. Как правило, кислоты и оксиды образуют пары, где кислота обладает меньшим количеством кислорода, чем оксид.
Например:
Сероводород (H2S) является кислотой, тогда как серный оксид (SO2) - оксид. Когда сероводород реагирует с серным оксидом, образуется сульфит натрия (Na2SO3) и вода (H2O).
Таким образом, соответствие кислоты и оксида может быть определено на основе их химической природы и реакций, которые они образуют при взаимодействии.
Как кислота соответствует оксиду?
Оксиды и кислоты могут быть взаимосвязаны и образовывать соединения друг с другом. Когда оксид реагирует с водой, происходит гидратация оксида и образуется соответствующая кислота.
Процесс образования кислоты из оксида называется гидратацией оксида. В этом процессе кислород из оксида соединяется с водой, образуя гидроксильные группы (-OH). Гидратация оксида приводит к образованию кислоты с соответствующей формулой.
Примером такой реакции может быть образование серной кислоты (H2SO4) из серного оксида (SO2). В этой реакции серный оксид растворяется в воде и образует серную кислоту:
SO2 + H2O → H2SO4
Таким образом, кислоты и оксиды связаны между собой через процесс гидратации оксида, который приводит к образованию соответствующей кислоты.
Примеры соответствия кислоты оксидам
Оксиды - это соединения, образованные из элемента и кислорода. Они могут быть основными (базическими) оксидами или кислотными оксидами.
Когда кислоты соединяются с оксидами, образуются соответствующие соли и вода. Этот процесс известен как нейтрализация кислоты.
Вот некоторые примеры соответствия кислоты оксидам:
1. Соляная кислота (HCl) - соответствующий ей оксид - хлористый водород (HClO).
2. Азотная кислота (HNO3) - соответствующий ей оксид - азотная кислота (N2O5).
3. Фосфорная кислота (H3PO4) - соответствующий ей оксид - фосфорный пентоксид (P2O5).
4. Угольная кислота (H2CO3) - соответствующий ей оксид - углекислый газ (CO2).
Это лишь несколько примеров соответствия кислоты оксидам. Существует много других кислот и оксидов, которые образуют соли и воду при нейтрализации.








