Кислотные свойства – это свойства веществ, проявляющиеся при реакции с щелочными веществами и влекущие за собой образование солей. Кислоты – это важный класс химических соединений, имеющих широкое применение в различных областях науки и техники. Понимание проявления кислотных свойств не только позволяет глубже изучить химию, но и находит свое применение в повседневной жизни.
При контакте с щелочными веществами кислоты проявляют ряд характерных признаков. Во-первых, они способны изменять цвет индикаторов. Например, лимонный сок взаимодействует с щелочью и меняет красный цвет лакмусовой бумажки на синий. Во-вторых, происходит выделение газов, таких как углекислый или серный. В-третьих, возникает тепло. Это может быть заметно во время реакции между щелочью и соляной кислотой, когда происходит выделение тепла.
Примерами кислотных веществ являются уксусная кислота, витамин C, соляная кислота и многие другие вещества, которые мы видим в повседневной жизни. Например, лимонный сок и яблочный сок содержат природные кислоты. Кислоты также применяются в галогенных лампах, аккумуляторах и в производстве различных материалов, таких как пластик и текстиль.
Особенностью проявления кислотных свойств является то, что они могут быть определены по ряду химических и физических параметров. Например, кислата обладают кислым вкусом, способностью растворяться в воде, проводить электрический ток и реагировать с щелочами. Кроме того, важным свойством кислот является их pH-значение. Кислоты обладают pH менее 7, в то время как щелочи имеют pH больше 7.
Кислотность в химии: определение и сущность
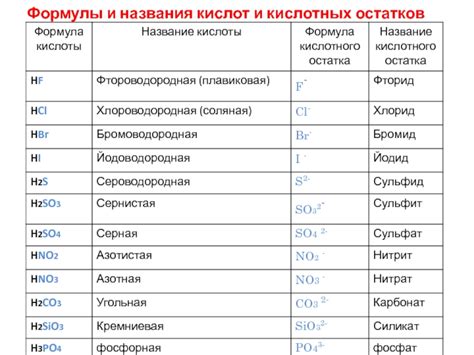
Кислотность можно проявить разными способами. Основные признаки кислотности включают:
| Признак кислотности | Описание | Примеры |
|---|---|---|
| Кислотные оксиды | Вещества, образующие кислотные растворы при реакции с водой. | Диоксид серы (SO2), диоксид углерода (CO2) |
| Кислотные соли | Соли, образованные в результате реакции нейтрализации кислоты с основанием. | Сульфат меди (II) (CuSO4), нитрат аммония (NH4NO3) |
| Кислотные реакции | Химические реакции, при которых происходит образование кислотных соединений. | Образование соляной кислоты (HCl) при реакции соляной кислоты с водой |
| Кислотные свойства | Химические свойства, связанные с образованием водородных ионов. | Способность кислоты реагировать с основаниями для образования солей |
Особенности кислотности включают в себя:
- Кислоты являются электролитами, т.е. способны проводить электрический ток в растворе.
- Кислотность зависит от концентрации водородных ионов (pH).
- Кислоты имеют коррозивные свойства и могут разрушать некоторые материалы.
- Кислоты могут изменять окраску индикаторов.
Как проявляются кислотные свойства в реакциях
Примером реакции, проявляющей кислотные свойства, является взаимодействие соляной кислоты с гидроксидом натрия:
HCl + NaOH → NaCl + H2O
В данной реакции соляная кислота (HCl) отдает протон гидроксиду натрия (NaOH), образуя воду (H2O) и соль (NaCl). Протонный перенос от кислоты к базе является типичным проявлением кислотных свойств.
Кислоты также могут проявлять свои свойства взаимодействием с металлами, образуя соли и выделяя водород. Например, реакция соляной кислоты с цинком:
2HCl + Zn → ZnCl2 + H2
В данной реакции соляная кислота взаимодействует с цинком, образуя соль (ZnCl2) и выделяя молекулы водорода (H2). Это также проявление кислотных свойств.
Кислотные свойства также проявляются в реакциях ацидования органических соединений, когда кислотные ионы добавляются к молекулярным соединениям, изменяя их химические и физические свойства.
Таким образом, кислотные свойства проявляются в реакциях кислот с базами, металлами и органическими соединениями. Все эти реакции характеризуются передачей протонов или добавлением кислотных ионов, что позволяет определить вещество как кислоту.
Примеры кислотных соединений в природе и повседневной жизни

Одним из наиболее известных примеров кислоты является соляная кислота (HCl), которая используется в промышленности для производства химических веществ и очистки металлов. Она также находит применение в бытовых целях, например, для удаления накипи или ржавчины.
Еще одним примером кислоты является лимонная кислота (C6H8O7), которая содержится во фруктах, таких как лимоны. Она широко используется в пищевой промышленности как консервант и ароматизатор. Также лимонная кислота применяется в бытовых целях, например, как очиститель для удаления накипи в чайниках или кофеварках.
Другим примером кислотного соединения является уксусная кислота (CH3COOH), которая широко используется в пищевой промышленности для консервации продуктов и в бытовых целях, например, как очиститель для удаления пятен с обуви или мебели.
Эти примеры лишь капля в море, так как в природе существует огромное количество различных кислотных соединений, каждое из которых имеет свои особенности и применение. Кислотные свойства играют важную роль в химии и постоянно окружают нас в повседневной жизни.
Как различить кислотные свойства от других типов химической активности
1. Вкус кислоты: Кислотные вещества ощущаются на вкус кисло. При попадании на язык они вызывают ощущение жжения и привкус кислоты.
2. Изменение цвета индикатора: Кислоты проявляют изменение цвета некоторых индикаторов. Например, лакмус при контакте с кислотой переходит из синего в красное состояние.
3. Реакция с щелочью: Кислоты образуют соли при реакции с щелочными растворами. При смешении кислоты и щелочи происходит нейтрализация, сопровождаемая выделением тепла и образованием воды.
4. Коррозионные свойства: Многие кислоты обладают высокой активностью по отношению к металлам и вызывают их коррозию. При контакте с металлом образуется соль кислоты и выделяется водород.
5. Проводимость электрического тока: Кислоты в растворе проявляют электролитические свойства - они приводят к повышению проводимости раствора.
Определение присутствия кислотных свойств у вещества позволяет исследователям классифицировать вещества и прогнозировать их реакционную активность. Знание характеристик кислотных свойств полезно для понимания реакций, происходящих в живых организмах и в химической промышленности.
Особенности кислотных соединений: свойства и применение

Одним из ключевых свойств кислот является их кислотная реакция с веществами. Кислоты способны образовывать соединения с основаниями, результатом такой реакции является образование солей и воды. Этот процесс называется нейтрализацией.
Применение кислотных соединений в различных областях науки и пр-и очень широко. Одним из наиболее распространенных примеров является использование сильных кислот в лабораторной практике для проведения реакций, очистки оборудования и настройки pH растворов.
Кислоты также играют важную роль в пищевой промышленности. Они используются для приправления, консервации и подкисления пищевых продуктов.
В медицине, кислоты применяются в процессе производства лекарств, в реализации лабораторных исследований, а также для обеззараживания инструментов.
Кислотные соединения находят применение и в промышленном производстве, например, в процессе получения удобрений, а также в качестве компонентов в производстве пластмасс, красок и лаков.
Таким образом, кислотные соединения обладают разнообразными свойствами и находят широкое применение в науке, промышленности и медицине.








