Ионная связь — это один из видов химической связи, которая возникает между атомами вещества в результате образования ионов. Вещества с ионной связью обычно состоят из положительно и отрицательно заряженных ионов, которые притягиваются друг к другу силой электростатического притяжения.
Основной характеристикой веществ с ионной связью является их высокая точка плавления и кипения, а также их хорошая растворимость в воде. Из-за сильных притяженных сил ионов вещества с ионной связью обладают такими свойствами, как твёрдость, хрупкость и хорошая электропроводность в расплавленном или растворенном состоянии.
Примерами веществ с ионной связью являются соли, металлы и некоторые неорганические соединения. Натрий, хлорид натрия, кальций, магний и оксиды – все эти соединения образуют кристаллы с ионной связью. Ионная связь также встречается в минералах, таких как галит, пирамида и кальцит.
Важно отметить, что вещества с ионной связью являются важными элементами в нашей жизни. Они используются в процессе производства стекла, керамики, драгоценных камней и других материалов, а также в электролизе и реакциях окисления-восстановления.
Вещества с ионной связью: основные характеристики и примеры

Вещества с ионной связью образуются между атомами, которые отдают и принимают электроны, образуя ионы с положительным и отрицательным зарядами. Ионная связь обладает рядом особенностей:
| Основные характеристики | Примеры веществ |
|---|---|
| 1. Вещества с ионной связью образуют соли и кристаллы | натриевый хлорид (NaCl), магниевый сульфат (MgSO4), кальций гидроксид (Ca(OH)2) |
| 2. Ионы могут быть положительными (катионами) или отрицательными (анионами) | кальциевые ионы (Ca2+), хлоридные ионы (Cl-), нитратные ионы (NO3-) |
| 3. Вещества с ионной связью обладают высокой температурой плавления и кипения | калий хлорид (KCl), барий нитрат (Ba(NO3)2), литий бромид (LiBr) |
| 4. Ионная связь является электростатической силой притяжения между ионами | кальций фосфат (Ca3(PO4)2), алюминий оксид (Al2O3), железо(III) гидроксид (Fe(OH)3) |
Важно отметить, что вещества с ионной связью обладают хорошей проводимостью электрического тока в расплавленном или растворенном состоянии, а в твердом состоянии они обычно не проводят электричество.
Что такое ионная связь и каковы её характеристики
Основные характеристики ионной связи:
- Электростатическая природа связи: ионная связь обусловлена притяжением ионов с противоположными зарядами. Электростатические силы действуют между положительно и отрицательно заряженными ионами и обеспечивают их удержание в кристаллической решетке или растворе.
- Твёрдое состояние: ионная связь характерна для многих твердых ионных соединений, которые формируют кристаллическую решетку. Она обеспечивает устойчивость кристаллической решетки и высокую температуру плавления ионных соединений.
- Ионный радиус: размеры ионов оказывают значительное влияние на силу ионной связи. Обычно ионные соединения имеют большую силу связи, если радиус ионов различается и они между собой дополняются по размеру.
- Растворимость: ионные соединения могут быть растворимыми в воде или других растворителях в зависимости от силы ионной связи. Более слабые ионы легче выходят из кристаллической решетки и переходят в раствор, создавая электролитическое растворение.
Примеры веществ с ионной связью:
- Хлорид натрия (NaCl): это одно из наиболее распространенных ионных соединений, которое образуется из натрия (Na+) и хлора (Cl-) и образует кристаллическую решетку. Благодаря ионной связи, хлорид натрия имеет высокую температуру плавления и проводит электрический ток в растворе.
- Сульфат магния (MgSO4): это соль, которая содержит ионы магния (Mg2+) и сульфата (SO42-). Благодаря ионной связи, сульфат магния формирует кристаллическую решетку и обладает растворимостью в воде.
- Оксид кальция (CaO): это соединение, состоящее из ионов кальция (Ca2+) и ионов кислорода (O2-). Благодаря ионной связи, оксид кальция обладает высокой температурой плавления и используется в производстве цемента.
Атомы и ионы: разница и роль в ионной связи
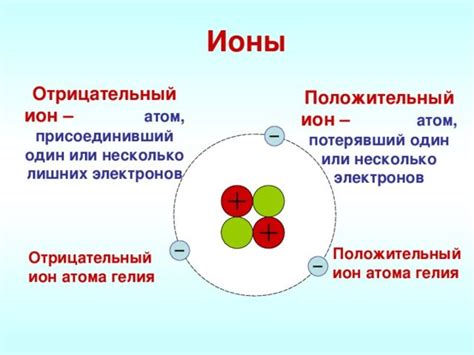
В отличие от атома, ион является атомом или группой атомов, которые имеют электрический заряд. Ион образуется, когда атом теряет или получает один или несколько электронов. Если атом теряет электрон, он становится положительно заряженным ионом, называемым катионом. Если атом получает электрон, он становится отрицательно заряженным ионом, называемым анионом.
Атомы и ионы играют важную роль в ионной связи. Ионная связь возникает между анионами и катионами по принципу притяжения противоположных зарядов. Когда атомы образуют кристаллическую решетку, положительно заряженные катионы окружаются отрицательно заряженными анионами. В результате образуется кристалл ионного соединения, такого как натрий хлорид (NaCl) или кальций оксид (CaO).
| Примеры ионных соединений | Катионы | Анионы |
|---|---|---|
| Натрий хлорид (NaCl) | Na+ | Cl- |
| Кальций оксид (CaO) | Ca2+ | O2- |
| Алюминий оксид (Al2O3) | Al3+ | O2- |
Электроны и ионы: их влияние на образование ионной связи
Электроны - это элементарные частицы, обладающие отрицательным зарядом и находящиеся вокруг атомного ядра. Основные роли электронов в образовании ионной связи:
- Электроны могут переходить с одного атома на другой, создавая положительно и отрицательно заряженные ионы.
- Перемещение электронов приводит к изменению электрического заряда атома и, следовательно, к образованию ионов.
- Электроны в валентной оболочке атомов определяют их электроотрицательность и возможность образования ионных связей.
| Тип ионной связи | Примеры веществ |
|---|---|
| Катионная | Хлорид натрия (NaCl) |
| Анионная | Хлорид калия (KCl) |
| Катионно-анионная | Сульфат магния (MgSO4) |
Ионы - это заряженные атомы или атомные комплексы, образующиеся в результате перехода электрона(-ов) от одного атома к другому. Ионы могут быть положительно заряженными (катионы) или отрицательно заряженными (анионы).
Образование ионной связи происходит при противоположном заряде ионов: положительные ионы притягивают отрицательные ионы, образуя кристаллическую решетку. Ионная связь характеризуется высокой прочностью и жесткостью, а также высокой температурой плавления и кипения веществ.
Важно отметить, что образование ионной связи может происходить не только между атомами, но и между атомами и молекулами вещества.
Примеры веществ с ионной связью: соли и оксиды
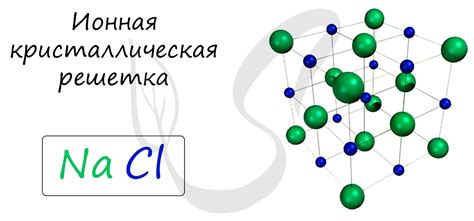
Вещества с ионной связью включают в себя различные соли и оксиды. Ионная связь возникает между положительно и отрицательно заряженными ионами, которые образуют кристаллическую структуру. Ниже приведены примеры некоторых веществ с ионной связью:
1. Соль натрия (NaCl) - это один из самых известных примеров вещества с ионной связью. Она состоит из положительно заряженных ионов натрия (Na+) и отрицательно заряженных ионов хлора (Cl-).
2. Соляная кислота (HCl) - является еще одним примером вещества с ионной связью. Она состоит из положительно заряженных ионов водорода (H+) и отрицательно заряженных ионов хлора (Cl-).
3. Магния оксид (MgO) - это оксидный соединение, которое также имеет ионную связь. Оно состоит из положительно заряженных ионов магния (Mg2+) и отрицательно заряженных ионов кислорода (O2-).
4. Алюминиевый оксид (Al2O3) - еще один пример оксида с ионной связью. Он состоит из положительно заряженных ионов алюминия (Al3+) и отрицательно заряженных ионов кислорода (O2-).
Это только некоторые примеры веществ с ионной связью. Соли и оксиды широко используются в различных областях науки и промышленности, включая химическую промышленность, металлургию и электронику.
Физические свойства веществ с ионной связью
Вещества с ионной связью обладают рядом специфических физических свойств, которые отличают их от веществ с другими типами химических связей.
Твердость: Вещества с ионной связью обычно являются твердыми веществами. Ионная связь характеризуется сильным притяжением между положительно и отрицательно заряженными ионами, что делает их структуру устойчивой и порождает кристаллическую сетку. Это приводит к тому, что вещества с ионной связью обладают высокой температурой плавления и кипения.
Электропроводность: Вещества с ионной связью обладают хорошей электропроводностью в расплавленном или растворенном состоянии. При этом они обычно не проводят электричество в твердом состоянии, так как ионы закреплены в кристаллической сетке и не имеют свободных электронов для перемещения.
Растворимость: Вещества с ионной связью обычно хорошо растворяются в полярных растворителях, таких как вода. Это связано с тем, что полярные молекулы растворителя взаимодействуют с ионами вещества, образуя с ними водородные связи или другие электростатические взаимодействия.
Хрупкость: Вещества с ионной связью обычно хрупкие, так как при деформации ионные связи легко нарушаются, что приводит к разрушению кристаллической структуры вещества.
Цветность: Некоторые вещества с ионной связью обладают ярким цветом. Это связано с тем, что при поглощении света электроны находятся в возбужденном состоянии и переходят на более высокие энергетические уровни, что приводит к изменению длины волны поглощенного света и, следовательно, к видимому цвету вещества.








