Элементарная реакция в химии — это процесс, во время которого происходит прямое превращение реагентов в продукты без образования промежуточных соединений. Важно отметить, что элементарные реакции являются основой для построения сложных химических реакций.
Основным принципом элементарных реакций является балансировка входных и выходных частиц. То есть, количество каждого типа атомов в реакциях должно быть одинаковым. Этот принцип помогает определить состав и исследовать кинетику реакций.
Примером элементарной реакции может быть горение метана (CH4) в атмосфере. В результате этой реакции образуются углекислый газ (CO2) и вода (H2O). Эта реакция можно записать следующим образом: CH4 + 2O2 ⟶ CO2 + 2H2O. Здесь каждая частица реагентов и продуктов представлена в отдельном соотношении, что подтверждает элементарность реакции.
Исследование элементарных реакций помогает ученым разработать эффективные катализаторы, понять причины возникновения нестационарности и, в конечном счете, применить полученные знания в синтезе новых соединений или улучшении процессов, происходящих в природе.
Что такое элементальная реакция?

Элементальная реакция является фундаментальным процессом в химии и позволяет учитывать и предсказывать химические переходы, взаимодействия и исследовать химические свойства веществ. Узнавая элементальную реакцию, можно оптимизировать процессы и управлять реакционными условиями, что находит применение в различных областях науки и промышленности.
Примером элементальной реакции является соединение водорода с кислородом при горении, где образуется вода (H2 + 1/2O2 → H2O). В этом случае участвуют отдельные атомы водорода и кислорода, образуя молекулу воды без промежуточных стадий.
Определение элементальной реакции
Одна элементальная реакция может быть описана с помощью химического уравнения, где показываются исходные реагенты и продукты реакции.
Элементальные реакции являются основными строительными блоками для понимания более сложных химических процессов. Изучение элементальных реакций позволяет определить механизмы химических превращений, предсказывать условия и интенсивность процессов, исследовать реакционные кинетику и термодинамику.
Примером элементальной реакции является горение метана (CH4). В данной реакции одна молекула метана соединяется с двумя молекулами кислорода (O2) и образует одну молекулу углекислого газа (CO2) и две молекулы воды (H2O).
CH4 + 2O2 -> CO2 + 2H2O
Принципы элементальной реакции
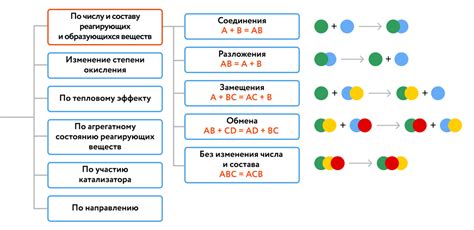
Принципы элементальной реакции включают в себя:
1. Присутствие только двух элементов.
В элементальной реакции участвуют только два элемента, которые могут быть представлены химическими символами. Эти два элемента могут быть присутствующими в начальных соединениях или продуктах реакции.
2. Прямое преобразование.
В результате элементальной реакции происходит прямое преобразование одного элемента в другой. Нет промежуточных стадий или образования сложных соединений. Например, реакция горения водорода: 2H2 + O2 → 2H2O.
3. Массовое сохранение.
Массовое сохранение - это принцип, согласно которому масса исходных элементов должна быть равна массе продуктов реакции. То есть, масса всех атомов в реакции должна быть сохранена.
4. Работа по закону Авогадро.
Закон Авогадро утверждает, что один молекулярный вес вещества содержит одинаковое количество частиц (атомов или молекул). Поэтому элементальная реакция должна выполняться в соответствии с этим законом.
5. Реакция должна быть возможной.
Для того чтобы элементальная реакция могла произойти, элементы должны быть в состоянии взаимодействовать друг с другом. Это означает, что должны быть выполнены условия, такие как наличие достаточной энергии активации, подходящих температурных и давлениях условий и т.д.
Все эти принципы являются основой элементарной химической реакции и помогают понять, как происходят простейшие химические превращения между элементами.
Примеры элементальных реакций
Элементальные реакции играют важную роль в химии и физике. Ниже представлены несколько примеров таких реакций:
1. Реакция горения: реакция между кислородом и горючим веществом, например, горение древесины. В результате этой реакции выделяется тепло и образуется углекислый газ и вода.
2. Реакция гидролиза: реакция разложения вещества под воздействием воды. Примером такой реакции является гидролиз соли. Например, гидролиз хлорида натрия приводит к образованию гидроксида натрия и хлороводорода.
3. Реакция окисления: реакция, в результате которой происходит передача электронов между веществами. Примером такой реакции является окисление железа, при котором железо соединяется с кислородом, образуя ржавчину.
4. Реакция синтеза: реакция, в результате которой два (или более) простых вещества соединяются, образуя сложное вещество. Например, синтез аммиака – соединение азота и водорода – с образованием аммиака.
| Реакция | Пример |
|---|---|
| Горение | Древесина + кислород = углекислый газ + вода + тепло |
| Гидролиз | Хлорид натрия + вода = гидроксид натрия + хлороводород |
| Окисление | Железо + кислород = ржавчина |
| Синтез | Азот + водород = аммиак |
Это лишь несколько примеров элементальных реакций. В химии существует множество других реакций, которые являются основой многих процессов и явлений в природе.
Элементальная реакция в органической химии

Ключевое условие элементарной реакции – это ее прямая возможность, т.е. реакционная смесь может прямо переходить в конечные продукты без участия промежуточных соединений. Это свойство позволяет исследователям изучать кинетические аспекты реакций, такие как скорость и механизм.
Примеры элементарных реакций в органической химии включают различные виды реакций, такие как замещение, аддиция, электрофильное или нуклеофильное ароматическое замещение, реакции окисления и восстановления и др. Эти реакции играют важную роль в синтезе органических соединений и позволяют создавать новые молекулы с нужными свойствами.
Следует отметить, что элементарные реакции могут быть сложными с точки зрения механизма, но все равно считаются элементарными, если не образуется промежуточных продуктов. Это позволяет упрощать изучение реакционной кинетики и понимать основные этапы реакции.
Соединение фундаментальных знаний о элементарных реакциях с применением методов современной химии способствует развитию прогрессивных методов синтеза и обеспечивает создание новых соединений для различных областей науки и технологии.
Элементальная реакция в неорганической химии
Элементальные реакции широко используются в неорганической химии для изучения свойств элементов, получения новых веществ и понимания механизмов химических процессов.
Принципы элементальных реакций:
- Только элементы или соединения с одним элементом могут быть вовлечены в реакцию;
- Реагенты должны быть чистыми и хорошо очищенными от примесей;
- Реакция должна проводиться в контролируемых условиях, таких как определенная температура и давление, чтобы обеспечить правильный ход реакции;
- Элементальные реакции обычно сопровождаются выделением или поглощением энергии в виде тепла или света.
Примеры элементальных реакций:
- Горение кислорода в атмосфере;
- Реакция между водородом и кислородом при образовании воды;
- Образование кислорода из перекиси водорода;
- Реакция железа с кислородом при образовании оксида железа;
- Реакция между хлором и натрием при образовании хлорида натрия.
Причины возникновения элементальных реакций
Элементальные реакции возникают в результате взаимодействия химических элементов или соединений, при котором происходит прямое превращение исходных веществ в конечные продукты без образования посредников или промежуточных стадий.
Основные причины возникновения элементальных реакций:
- Энергия активации: процесс начинается только при наличии достаточно высокой энергии активации, которая обеспечивает преодоление барьера инициации реакции.
- Столкновение молекул: элементальные реакции требуют столкновения исходных молекул или атомов для их последующего превращения в продукты реакции.
- Отсутствие реагентов: для элементальных реакций характерно, что они происходят без участия посредников или внешних реагентов.
- Прямая превращения: в отличие от сложных реакций, элементальные реакции происходят без образования промежуточных продуктов или стадий.
Примеры элементальных реакций включают горение, окисление-восстановление, разложение и многие другие процессы, которые происходят в естественных и промышленных условиях.
Влияние физических факторов
Физические факторы могут значительно влиять на протекание элементарных реакций. Они могут изменять скорость реакции, выбор продуктов реакции или даже приводить к изменению механизма реакции. Рассмотрим основные физические факторы, которые оказывают влияние на элементарные реакции:
- Температура: Изменение температуры может привести к ускорению или замедлению скорости реакции. Повышение температуры обычно увеличивает скорость реакции, так как повышение температуры увеличивает энергию молекул и способствует их более эффективному столкновению.
- Давление: Увеличение давления может повысить скорость реакции, особенно если реагенты находятся в газообразном состоянии. Повышение давления увеличивает концентрацию молекул и способствует их частым столкновениям, что увеличивает вероятность успешной реакции.
- Концентрация: Увеличение концентрации реагентов может увеличить скорость реакции, поскольку увеличивает число частиц, способных к столкновению. Высокая концентрация реагентов повышает вероятность успешной реакции.
- Растворитель: Выбор растворителя может влиять на скорость реакции и выбор продуктов. Различные растворители могут служить катализаторами реакции или изменять реакционное окружение, что может изменить протекание реакции.
- Излучение: Излучение, такое как ультрафиолетовое излучение или радиация, может приводить к инициации реакции или изменению ее ходу. Излучение может вызывать разрыв химических связей или создавать радикалы, которые являются активными участниками реакции.
Все эти физические факторы могут оказывать существенное влияние на протекание элементарных реакций и их результаты. Понимание и контроль этих факторов позволяет управлять реакциями и создавать оптимальные условия для получения нужного продукта.








