Амфотерное соединение — это вещество, способное проявлять свойства как кислоты, так и основания при реакции с другими химическими соединениями. Такое соединение может принимать водородионы (когда ведет себя как кислота) и отдавать ион гидроксид-ион (когда ведет себя как основание).
Амфотерные соединения встречаются в различных классах химических веществ, включая неорганические соли, кислоты, окислители, гидроксиды и многие другие. Например, водород оксид (вода) является типичным амфотерным соединением. Вода, обладая водородными и гидроксильными группами, может реагировать как с кислотами, так и с щелочами, образуя различные соли.
Известными примерами амфотерных соединений, помимо воды, являются алюминий гидроксид, железо гидроксид, амфотерная глина и амфотерный оксид свинца. Эти вещества могут проявлять кислотные или основные свойства в зависимости от условий реакции.
Понимание концепции амфотерных соединений является важным для изучения химии и позволяет более точное описание и объяснение химических реакций, а также расширяет возможности в контексте научных исследований и технологического применения веществ. Знание амфотерных свойств различных химических веществ помогает ученым разрабатывать новые материалы и решать ряд практических задач в различных отраслях науки и техники.
Амфотерное соединение: понятие и примеры
Термин "амфотерное" происходит от греческих слов "амфи", что означает "оба", и "терос", что можно перевести как "конец", "сторона". Это значит, что амфотерное соединение может реагировать и с кислотами, и с основаниями.
У амфотерных соединений есть способность принимать или отдавать протоны (H+ и OH-) в химических реакциях. В зависимости от условий и среды, амфотерное соединение может выступать в реакциях как кислота, давая протоны, или как основание, принимая протоны. Такие реакции являются характерными для амфотерных соединений.
Примером амфотерного соединения является вода (H2O). Вода может реагировать как кислота, отдавая протон, и как основание, принимая протон. В кислотных условиях вода действует как основное вещество, принимая протон, и образуя гидроксидные ионны (OH-). В щелочных условиях вода действует как кислота, отдавая протон, и образуя гидроксониумные ионы (H3O+).
Еще одним примером амфотерного соединения является аммиак (NH3). Аммиак может реагировать и с кислотами, и с основаниями. В реакции с кислотами он действует как основание, принимая протон и образуя ион аммония (NH4+). В реакции с основаниями он действует как кислота, отдавая протон и образуя ион гидроксида (OH-).
Дефиниция амфотерного соединения
Основным примером амфотерного соединения является вода (H2O). Вода может действовать как кислота в реакции с сильным основанием, например с гидроксидом натрия (NaOH), образуя нейтральную соль натрия и воду:
H2O + NaOH → NaOH2O + H2O
Вода также может действовать как основание при реакции с кислотой, например с соляной кислотой (HCl), образуя нейтральную соль хлорида натрия и воду:
H2O + HCl → NaCl + H2O
Другим примером амфотерного соединения является оксид алюминия (Al2O3). Он может реагировать как с кислотами, так и с основаниями, образуя соответствующие соли.
Амфотерные соединения играют важную роль в химии и имеют широкое применение в различных областях, включая производство химических соединений, фармацевтику, пищевую промышленность и другие.
Химические свойства амфотерных соединений

Типичными примерами амфотерных соединений являются оксиды некоторых металлов, в которых они обладают и кислотными и щелочными свойствами. Например, оксид алюминия (Al2O3) является амфотерным веществом, которое может реагировать как с кислотами (например, соляной кислотой) и образовывать алюминаты, так и с щелочами (например, натрием гидроксидом) и образовывать алюминаты. Другим примером является вода (H2O), которая может выступать как кислота и давать ионы гидроксонация (OH-), так и как основание, образуя ионы гидрогидроксид (H3O+).
- Алюминий оксид (Al2O3)
- Цинковый оксид (ZnO)
- Серный оксид (SO2)
Амфотерные соединения играют важную роль в химических реакциях и в промышленности. Их свойства и возможность взаимодействия с различными соединениями делают их полезными в различных процессах, таких как производство керамики, стекла, электролитическое осаждение металлов и многих других.
Примеры амфотерных веществ
| Вещество | Проявление свойств |
|---|---|
| Вода (H2O) | Вода может действовать как кислота, отдавая протоны, и как основание, принимая протоны. |
| Амфотерная глина | Глина может вступать в реакцию как с кислотами, так и с основаниями. |
| Гидроксид алюминия (Al(OH)3) | Гидроксид алюминия может реагировать как с кислотами, так и с основаниями. |
| Аминокислоты | Некоторые аминокислоты, например, глицин, способны проявлять свойства как кислоты, так и основания. |
Это лишь некоторые примеры амфотерных веществ. Другие вещества также могут обладать амфотерными свойствами в зависимости от условий реакции.
Амфотерность в органической химии
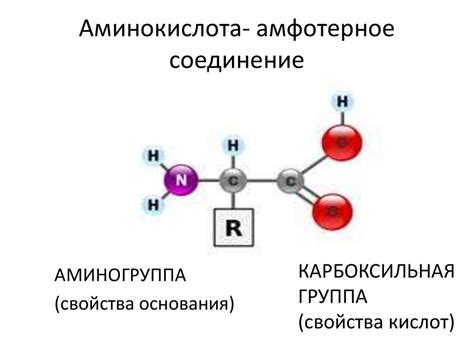
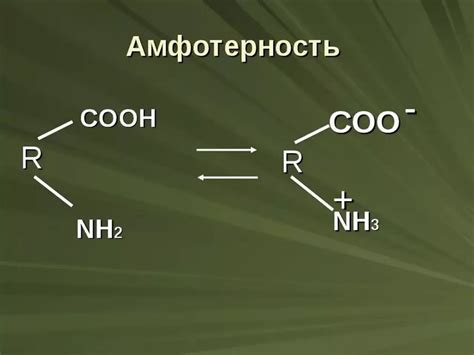
Примером амфотерного соединения в органической химии может служить аминокислота. Аминокислоты являются основными строительными блоками белков и встречаются во всех живых организмах. Они обладают как кислотными, так и щелочными свойствами, так как в их структуре присутствуют и кислотные (карбоксильная группа), и щелочные (аминогруппа) функциональные группы. Такое свойство позволяет аминокислотам реагировать с другими веществами, например, с кислотами или основаниями, и образовывать соли и воду.
Амфотерность аминокислот играет важную роль в биохимических реакциях организма, таких как образование белков, кислотно-щелочной баланс и регуляция pH внутренней среды организма.
| Пример | Аминокислота | Реакция |
|---|---|---|
| 1 | Глицин | Глицин + HCl → Глициний хлорид + H2O |
| 2 | Лизин | Лизин + H2SO4 → Лизинсульфат + H2O |
| 3 | Аспартат | Аспартат + NaOH → Аспартатнатрий + H2O |
Таким образом, амфотерные соединения в органической химии представляют собой вещества, которые могут проявлять и кислотные, и щелочные свойства, что обусловлено наличием в их структуре соответствующих функциональных групп.
Роль амфотерных соединений в жизни организмов
Амфотерные соединения играют важную роль в жизни организмов, так как они способны взаимодействовать и реагировать как с кислотами, так и с щелочами. Это свойство позволяет им выполнять разнообразные функции, необходимые для нормального функционирования клеток и организмов в целом.
Одним из примеров амфотерных соединений является вода – основный компонент всех живых организмов. Вода является амфотерным соединением, так как она может взаимодействовать и образовывать ионы как кислоты, так и щелочи. Кроме того, вода играет ключевую роль во всех биологических процессах, таких как растворение и транспортировка веществ, регулирование температуры и участие в химических реакциях клеток.
Другим примером амфотерных соединений являются аминокислоты – основные строительные блоки белков. Аминокислоты имеют как кислотные, так и щелочные группы, что позволяет им взаимодействовать с другими молекулами и участвовать в различных биологических процессах, таких как синтез белков, регуляция ферментативной активности и передача нервных импульсов.
Таким образом, амфотерные соединения являются неотъемлемой частью биологических систем. Их способность взаимодействовать как с кислотами, так и с щелочами позволяет им выполнять разнообразные функции, необходимые для поддержания нормального функционирования организмов и их клеток.
Амфотерная оксигидроксидная реакция
Одним из примеров амфотерных соединений являются оксигидроксиды - соединения, которые состоят из гидроксильной группы (-OH) и кислородсодержащего элемента.
Амфотерная оксигидроксидная реакция - это реакция между оксигидроксидом и веществом, проявляющим кислотные или основные свойства. В таких реакциях оксигидроксид может действовать как кислотное или основное соединение.
Например, оксид алюминия (Al2O3) является амфотерным соединением. Он реагирует с кислотами, проявляя основные свойства, образуя соли. Например:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Оксид алюминия также реагирует с основаниями, проявляя кислотные свойства, образуя соли. Например:
Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
Таким образом, амфотерная оксигидроксидная реакция показывает, что оксигидроксиды могут вести себя как кислоты или основания в зависимости от реагента, с которым они взаимодействуют.
Амфотерные классы веществ
Примером амфотерного класса веществ являются оксиды. Оксиды - это соединения, состоящие из химической связи с кислородом и одним или несколькими другими элементами. Некоторые оксиды могут проявлять кислотные свойства, реагируя с основаниями и образуя соль и воду. Например, оксид алюминия (Al2O3) реагирует с гидроксидом натрия (NaOH) и образует соль алюмината натрия (NaAlO2) и воду:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Однако оксиды также могут проявлять основные свойства, реагируя с кислотами и образуя соль и воду. Например, оксид цинка (ZnO) реагирует с соляной кислотой (HCl) и образует соль хлорида цинка (ZnCl2) и воду:
ZnO + 2HCl → ZnCl2 + H2O
Таким образом, оксиды являются примером амфотерных классов веществ, так как они могут проявлять и кислотные, и основные свойства в зависимости от условий реакции.
Сравнение амфотерных и нейтральных веществ

В отличие от амфотерных веществ, нейтральные вещества не проявляют ни кислотные, ни основные свойства. Они не реагируют с кислотами и основаниями и обладают нейтральным pH.
Чтобы лучше понять различие между амфотерными и нейтральными веществами, рассмотрим примеры каждого:
| Пример амфотерного вещества | Пример нейтрального вещества |
|---|---|
| Вода (H2O) | Этанол (C2H5OH) |
| Вода реагирует с кислотами и основаниями, образуя ионные соединения. Например, сильные кислоты реагируют с водой, образуя гидроксоны кислоты (например, HCl + H2O = H3O+ + Cl-), а сильные основания реагируют с водой, образуя гидроксиды (например, NaOH + H2O = Na+ + OH-). | Этанол не проявляет кислотные или основные свойства и не реагирует с кислотами или основаниями. Он остается нейтральным. |
Таким образом, амфотерные вещества имеют способность проявлять как кислотные, так и основные свойства, тогда как нейтральные вещества не обладают ни кислотностью, ни основностью.
Применение амфотерных соединений в технологии
Амфотерные соединения, способные реагировать и взаимодействовать с кислотами и щелочами, находят широкое применение в различных технологических процессах. Они играют важную роль в таких областях, как:
- Химическая промышленность: амфотерные соединения используются в производстве различных химических веществ. Они могут служить как каталитические агенты, участвующие в химических реакциях, так и основой для синтеза различных соединений.
- Электроника и полупроводники: амфотерные соединения, такие как галлий арсенид (GaAs), используются в производстве полупроводниковых приборов, таких как транзисторы и фотодиоды. Они обладают свойствами, позволяющими контролировать их электрическую проводимость.
- Керамика и стекло: амфотерные соединения широко применяются в производстве керамических и стеклянных изделий. Они обладают высокой термической стабильностью, механической прочностью и хорошей способностью к формовке.
- Фармацевтическая и медицинская промышленность: амфотерные соединения могут быть использованы в производстве лекарственных препаратов, так как они могут взаимодействовать с различными типами рецепторов в организме человека.
Применение амфотерных соединений в технологии позволяет расширить возможности производства и использования различных материалов, обеспечивая улучшение и развитие различных отраслей промышленности.








